Oxihemoglobin -Eigenschaften, Struktur und Verbindungskurve
- 3268
- 593
- Joe Hartwig
ENTWEDERXihemoglobin Es ist der Name, den Hämoglobin erhält, wenn es Sauerstoff anschließt. Hämoglobin ist ein Protein, das sich in den roten Blutkörperchen befindet und deren Hauptfunktion darin besteht, Sauerstoff aus den Lungen zu den Geweben zu transportieren.
Die ersten Lebewesen waren einzellig und lebten in einer flüssigen Atmosphäre, aus der sie genährt wurden und an denen sie ihren Abfall beseitigten, sowie einige der derzeit existierenden Organismen. Unter diesen Bedingungen werden diese Prozesse durch einfache Verbreitungsmechanismen erreicht, da sich die Zellwand in engstem Kontakt mit dem Medium hat, das sie liefert.
 Dissoziationskurve des Oxihemoglobins (Quelle: Ratznium bei englischen Wikipedialat -Versionen wurden von Aaronsharpe in IN hochgeladen.Wikipedia. [Public Domain] über Wikimedia Commons)
Dissoziationskurve des Oxihemoglobins (Quelle: Ratznium bei englischen Wikipedialat -Versionen wurden von Aaronsharpe in IN hochgeladen.Wikipedia. [Public Domain] über Wikimedia Commons) Die Entwicklung immer komplexer plurizellulärer Organismen implizierte, dass interne Zellen erheblich von der Umwelt entfernt waren, so.
So wurden spezielle Systeme entwickelt, um Nährstoffe und Gase wie das Verdauungssystem und das Atmungssystem sowie Transportmechanismen zu erhalten, um diese Nährstoffe und Gase in die Zelle zu bringen: das Herz -Kreislauf -System.
Um Energie in Form von ATP -Molekülen zu produzieren, benötigen Zellen Sauerstoff. Angesichts der Tatsache, dass der ATP nicht gespeichert werden kann, muss sie ständig synthetisiert werden, was einen dauerhaften Nachfrage nach Sauerstoff durch Zellen bedeutet.
Hämoglobin trat evolutionär als Gastransporter auf, der das Problem des Sauerstofftransports von der Umwelt in die Zelle "löst".
[TOC]
Eigenschaften und Struktur
Um über die Eigenschaften und die Struktur von Oxyhämoglobin zu sprechen. Daher werden von nun an die gemeinsamen Eigenschaften des Moleküls in Gegenwart oder nicht des fraglichen Gass beschrieben.
Was ist Hämoglobin für?
Hämoglobin ist notwendig, um Sauerstoff in die Menge und Geschwindigkeit in das Gewebe zu transportieren.
Kann Ihnen dienen: Beweise der Evolution der LebewesenWie ist ein Hämoglobinmolekül??
Hämoglobin ist ein tetrameres Protein (das vier Untereinheiten hat) eine kugelförmige Form und eine molekulare Masse von 64 kDa hat.
Seine vier Untereinheiten bilden eine einzelne funktionale Einheit, in der jeweils jeder wechselseitig die andere beeinflusst. Jede Untereinheit besteht aus einer Polypeptidkette, Globin und einer Prothesengruppe, der HEMO- oder "HEM" -Gruppe, die als Cofaktor wirkt und nicht durch Aminosäuren gebildet wird; Das heißt, es ist keine Protein Natur.
Globin ist auf zwei Arten: Alpha Globin und Beta Globin. Das Hämoglobin -Tetramer besteht aus einem Paar Alpha -Globin -Ketten (141 Aminosäuren) und einigen Beta -Globin -Ketten (146 Aminosäuren).
Jede der vier Polypeptidketten ist mit einer Hämogruppe verbunden, die ein Eisenatom im Eisenzustand (Fe2+) in der Mitte hat.
Wie ist die Hemogruppe?
Die Hämogruppe ist ein Porphyrinring, der durch vier pyrrolische Ringe (heterocyclische aromatische Verbindungen mit der Formel C4H5N) durch Methylbrücken gebildet wird. Das im Zentrum gefundene Eisen im Eisenstaat ist der Struktur durch koordinierte Stickstoffverbindungen ausgesetzt.
Jede Hämogruppe kann sich einem Sauerstoffmolekül beitreten, sodass jedes Hämoglobinmolekül nur 4 Gasmoleküle beitreten kann.
Der menschliche Körper enthält ungefähr 2,5 x 1013 Erythrozyten, die die Blutzellen sind, die Hämoglobin produzieren und transportieren. Jedes Erythrozyten hat etwa 280 Millionen Hämoglobinmoleküle und kann dann mehr als 1000 Millionen Sauerstoffmoleküle transportieren.
Kann Ihnen dienen: Hominierungsprozess: Eigenschaften und PhasenWie wird Oxyhämoglobin gebildet??
Oxihemoglobin wird nach der Vereinigung eines Sauerstoffatoms zu jedem Eisen -Eisenatom gebildet, das in jeder Hämogruppe des Hämoglobinmoleküls findet.
Der Begriff Oxihemoglobin bezieht sich dann auf ein sauerstoffhaltiges und nicht chemisch oxidiertes Hämoglobin, da es in Kombination mit Sauerstoff und Eisenresten im Eisenzustand kein Elektron verliert.
Die Sauerstoffversorgung führt zu einer Änderung der quaternären Struktur des Moleküls, dh einer Änderung der Konformation, die von den Globinketten auf die Hemo übertragen werden kann und umgekehrt umgekehrt.
Was ist die maximale Sauerstoffmenge, die Hämoglobin laden kann?
Hämoglobin kann höchstens vier Sauerstoffmoleküle in seine Struktur beitreten. Wenn das Molvolumen der idealen Gase 22 beträgt.4 l/mol, ein Mol Hämoglobin (64.500 g) wird mit 89 zusammenarbeiten.6 Liter Sauerstoff (4 Mol O2 x 22.4 l/mol).
Also muss jedes Gramm Hämoglobin 1 beitreten.39 ml O2, um 100% gesättigt zu sein (89.6l/64500g x (1000 ml/l)).
In der Praxis zeigen Blutuntersuchungen geringfügige Ergebnisse, da es geringe Mengen an Methämoglobin (oxidiertes Hämoglobin) und Carboxyhämoglobin (Hämoglobin + Kohlenmonoxid (CO)) gibt, die nicht mit Sauerstoff beitreten können.
Unter Berücksichtigung dessen „hüfner“ -Regel legt fest, dass im Blut 1 g Hämoglobin eine maximale Fähigkeit hat, den Sauerstoff von 1 zu vereinen.34ml.
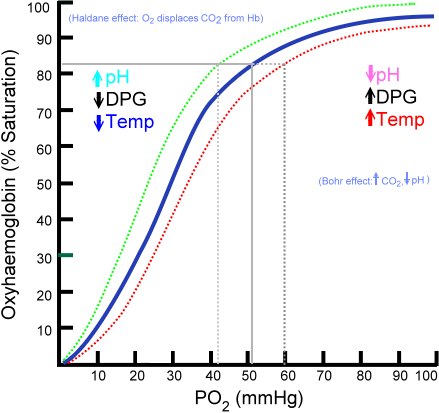
Oxyhemoglobin -Bindungskurve
Die Menge an Sauerstoffmolekülen, die mit einem Hämoglobinmolekül verbunden werden können. In Abwesenheit von Sauerstoff ist Hämoglobin deoxygeniert, aber mit zunehmendem PO2 steigt die Anzahl der Sauerstoff, die an Hämoglobin bindet.
Der Sauerstoffbindungsprozess an Hämoglobin abhängig vom partiellen Sauerstoffdruck. Bei der Grafik wird das Ergebnis als "Oxihemoglobin -Kurve" bezeichnet und hat eine charakteristische Form von 's' oder Sigmoid.
Kann Ihnen dienen: TaxismusAbhängig vom PO2 ist Hämoglobin in einer geringeren oder größeren Fähigkeit, den von ihm transportierenden Sauerstoff zu "freizusetzen" oder zu "liefern" und damit zu beladen und damit zu beladen ".
Zum Beispiel erhalten Sie in der Region zwischen 10 und 60 mmHg Druck den Teil mit mehr bis zur Kurve. In diesem Zustand kann Hämoglobin leicht große Mengen O2 ergeben. Dies ist der Zustand, der in den Geweben erreicht wird.
Wenn PO2 zwischen 90 und 100 mmHg (12 bis 13 kPa) liegt, ist das Hämoglobin fast 100% mit O2 gesättigt; Und wenn der arterielle PO2 60 mmHg (8 kPa) beträgt, ist die Sättigung mit O2 immer noch bis zu 90%.
In den Lungen sind dies die Bedingungen, die vorherrschen.
Diese Sigmoidform, die die Oxihemoglobin -Kurve zeichnet, stellt sicher verlangen.
Verweise
- Fox, s. Yo. (2006). Humanphysiologie 9. Ausgabe (pp. 501-502). McGraw-Hill Press, New York, USA.
- Murray, r. K., Granner, d. K., Mayes, p. ZU., & Rodwell, V. W. (2014). Harpers illustrierte Biochemie. McGraw-Hill.
- Rawn, j. D. (1998). Biochemie (1989). Burlington, North Carolina: Neil Patterson Publishers (C) N. Lalioti, cp raptopoulou, a. Terzis, a. Panagiotopoulos, sp Perlepes und. Manes-Zouopa, j. Chem. SOC. Dalton trans, 1327.
- Robert m. Berne, Matthew n. Erheben. (2001) Physiologie. (3. Aufl.) Harcourt Editions, s.ZU.
- West, J. B. (1991). Physiologische Grundlage der medizinischen Praxis. Williams & Wilkins
- « Erythropoietin (EPO) Eigenschaften, Produktion, Funktionen
- Dystrophineigenschaften, Struktur und Funktionen »

