Subatomische Partikel
- 4175
- 553
- Luca Holdt
 Hauptsubatompartikel
Hauptsubatompartikel Was sind subatomare Partikel?
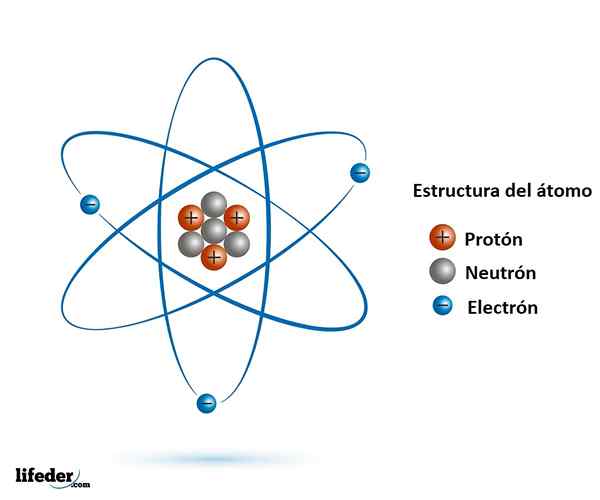
Der Subatomische Partikel Sie sind kleiner als das Atom und sind in der Natur gefunden, fast alle sind Teil davon. Wir kennen gut die Haupt- und Stabilste, nämlich das Elektron, das Proton und das Neutron.
Alle Materie besteht aus diesen Partikeln, obwohl es andere gibt, obwohl seine Existenz lange Zeit ignoriert wurde. Die ersten Atommodelle, die aus einigen Jahrhunderten vor Christus stammen, nahmen an, dass Atome unteilbar waren, so etwas wie Murmeln, die, wenn sie auf eine bestimmte Weise kombiniert wurden.
Als erfunden wurde, dass es nicht so war, dank der Entdeckungen des Elektrons im 19. Jahrhundert und des Atomkerns zu Beginn des 20. Jahrhunderts fragten sich die Wissenschaftler, ob diese Partikel eine innere Struktur hatten.
Es stellte sich heraus, dass sowohl das Proton als auch das Neutron Partikel aus noch kleineren sind, die keine interne Struktur haben: Sie sind die Elementarpartikel.
Deshalb werden subatomare Teilchen unterteilt in:
- Zusammengesetzte Partikel.
- Elementarteilchen.
Elementarpartikel sind Quarks, Gluonen und Leptone. Quarks und Gluonen bilden Protonen und Neutronen, während das Elektron, ein Elementarteilchen, ein Lepton ist.
Entdeckung subatomarer Partikel
Die Entdeckungen der subatomaren Partikel begannen aus dem neunzehnten Jahrhundert, und die erste, die gefunden wurde, war das Elektron.
Bis 1890 waren Physiker sehr damit beschäftigt, Strahlung und Übertragung elektromagnetischer Wellen zu untersuchen. J. J. Thomson war einer von ihnen und führte zahlreiche Experimente mit einer Röhre durch, zu der die Luft extrahiert und ein paar Elektroden angelegt worden war.
 J. J. Thomson
J. J. Thomson Als eine Spannung angewendet wurde. J. Thomson (1856-1940) entdeckte, dass sie aus negativ geladenen Partikeln bestand.
Thomson erhielt den Quotienten zwischen Last und Masse dieser Partikel: 1.76 x 108 C/g, wo c bedeutet Coulomb, Die Einheit für elektrische Ladung im internationalen System von Einheiten und G ist Gramm.
Kann Ihnen dienen: Lichtrefraktion: Elemente, Gesetze und ExperimentUnd er fand zwei sehr wichtige Dinge, die erste, dass die Masse der Partikel extrem klein war, und zweitens, dass dieser Wert für alle gleich war, unabhängig davon, was die Elektroden gemacht wurden.
Der Wert der Last wurde kurz darauf zu Beginn der 1900er Jahre vom amerikanischen Physiker Robert Millikan (1868-1953) und seinen Mitarbeitern dank des Experiments von gefunden der Ölabfall.
Der Atomkern: Protonen und Neutronen
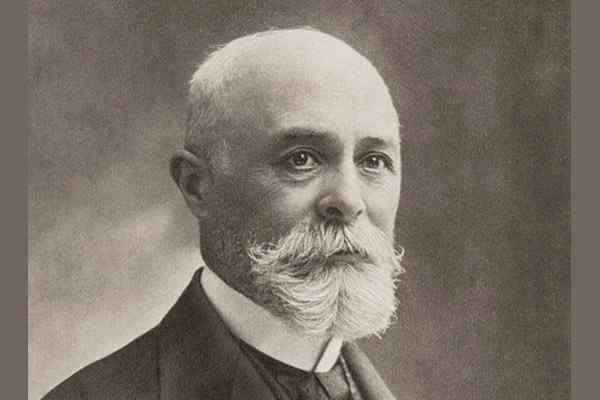 Henri Becquerel Porträt
Henri Becquerel Porträt Ende des 19. Jahrhunderts hatte Henri Becquerel (1852-1908) das Phänomen der natürlichen Radioaktivität entdeckt, das andere Physiker wie die Ehepartner Marie und Pierre Curie sowie die neozygous Ernest Rutherford faszinierten.
Letztere fanden drei verschiedene Strahlungsarten aus Uranproben, ein gut bekanntes radioaktives Element. Er benannte sie mit den ersten drei Buchstaben des griechischen Alphabets: α, β und γ.
Rutherford Dispersionsexperimente
 Der junge Ernest Rutherford
Der junge Ernest Rutherford Mit den α -Partikeln, sehr energisch und positiv beladen, Rutherford Bombard.
Aber merkwürdigerweise wurde ein kleiner Teil der Partikel umgeleitet und einige sprangen sogar in die entgegengesetzte Richtung ab. Letzteres war unvorstellbar, denn wie Rutherford sagte, war es wie mit einem Gewehr ein dünnes Taschentuch und sah, dass die Kugeln zurückkehren.
Der Grund, warum die α -Partikel abweichen. Dies ist der Atomkern, der winzig ist, aber das enthält fast die gesamte Masse des Atoms.
Die Entdeckung von Neutron
 James Chadwick
James Chadwick Das Neutron brauchte etwas länger und war dem englischen Physiker James Chadwick (1891-1974), Rutherford Student, zu verdanken. Rutherford selbst hatte die Existenz eines Teilchens ohne Belastung im Kern vorgeschlagen, um zu erklären, warum dies aufgrund der elektrostatischen Abstoßung nicht zerfallen ist.
Chadwick -Experimente zeigten 1932 die Existenz einer Masse der Masse, die dem des Protons sehr ähnlich ist, jedoch ohne Last. Deshalb nannten sie sie Neutron und neben dem Proton, sie sind die wesentlichen Bestandteile des Atomkerns.
Kann Ihnen dienen: Elektromagnetische Energie: Formel, Gleichungen, Verwendungen, BeispieleDie wichtigsten subatomaren Partikel
Im Allgemeinen sind subatomare Teilchen durch Have:
- Masse.
- Elektrische Ladung.
- Drehen.
Der Spin ist eine Qualitätsanalogie zur Drehung auf der Achse, aber völlig quantendarme Natur. Und andererseits gibt es Partikel mit Last und Masse 0 wie Photon.
Elektron
Das Elektron ist ein stabiles subatomares Partikel, das negativ belastet und zur Leptonengruppe gehört, die mit der niedrigsten Masse ist. Es ist ein wesentlicher Bestandteil des Atoms, es kann jedoch in Form von isoliert existieren freie Elektronen.
Tatsächlich ist es die kleinste elektrische Ladung, die in der Natur gefunden werden kann, daher ist jedes andere das Vielfache des Elektrons gemäß dem Prinzip der Quantisierung der Last.
Seine Hauptmerkmale sind:
- Messe: 9.1 x 10-31 kg
- Last: e = -1.6 x 10-19 C
- Spin: ± ½
- Antipartikel: Positron.
Das Elektron ist für die Bildung chemischer Bindungen sowie in der elektrischen und thermischen Leitung verantwortlich. Und dank der Quantenmechanik wissen wir, dass das Elektron ein doppeltes Verhalten hat: gleichzeitig Welle und Teilchen.
Proton
Es handelt.
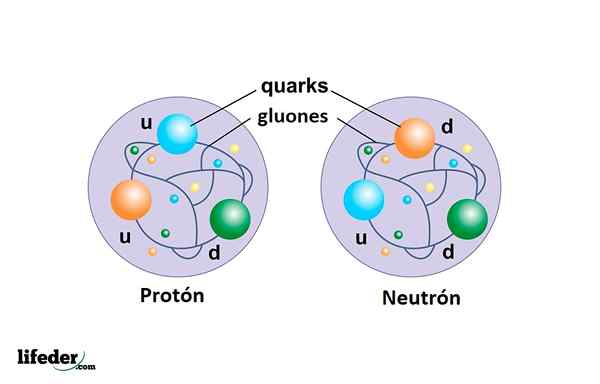
Das Proton ist kein Elementarteilchen wie das Elektron, sondern besteht aus drei Quarks, die von vereint sind Gluones Und es ist viel massiver als das Elektron.
Im Gegensatz zu diesem ist das Proton auf den Atomkern beschränkt, und seine Menge bestimmt, welches Element er ist und seine Eigenschaften.
- Messe: 1.672 x 10-27 kg
- Last: e = +1.6 x 10-19 C
- Spin: ½
- Antipartikel: Antiproton.
Neutron
Das Neutron neben dem Proton bildet den Atomkern und besteht auch aus drei Quarks: zwei der Typen Runter und eine vom Typ HOCH.
- Messe: 1.675 x 10-27 kg
- Keine Netzlast.
- Spin: ½.
Es ist ein stabiles Teilchen im Atomkern, aber als freies Teilchen nimmt es mit einem halben Leben von etwa 10 ab.Ungefähr 3 Minuten. Seine Masse ist kaum größer als die des Protons und wie wir gesagt haben, fehlt ihr die Nettobelastung.
Kann Ihnen dienen: latente HitzeDie Anzahl der Neutronen eines Atoms ist wichtig, da es zwar nicht die Art des Elements bestimmt, wie der Proton, die Isotopenklasse bestimmt.
Die Isotope eines Elements sind Varianten desselben und ihr Verhalten kann sich sehr voneinander unterscheiden. Es gibt stabil und instabil, zum Beispiel hat Wasserstoff wie Isotope das Deuterium und Tritium.
Bombardieren Neutronenatome bestimmter Uran- und Plutoniumverbindungen, der Kern ist Fell. Die auftritt.
Quarks

Sie sind die Bestandteile von Protonen und Neutronen. Bisher wurden 6 Arten von Quarks gefunden, aber keine als freies Teilchen, sondern mit anderen zusammengesetzten Partikeln verbunden.
Der Nachweis seiner Existenz wurde durch Experimente, die seit den 60er Jahren durchgeführt wurden.
- Last: +2/3e, -1/3e
- Spin: ½
- Antipartikel: Antiquark.
Andere Partikel
Ab 1930 folgten die Entdeckungen neuer Partikel, von denen viele von der Theorie vorhergesagt wurden. Das Standard -Partikelmodell betrachtet die Existenz von 17 Arten von grundlegenden Partikeln, zwischen Quarks, Leptons, Bosonen und dem Boson von Higgs.
Sie haben auch ihre jeweiligen Antipartikel, die beim Interaktion vernichtet werden und neue Partikel erzeugen. Hier sind einige davon:
-Positron, identisch mit dem Elektron, aber mit positiver Belastung.
-Neutrino ohne Last.
-Meson.
-Bosonen, die die Träger der grundlegenden Wechselwirkungen sind, außer der Schwerkraft.
-Der Boson von Higgs, verantwortlich für die Masse.
-Gravitón ist ein vorgeschlagenes Teilchen zur Erklärung der Schwerkraft, aber es gibt immer noch keine Beweise dafür, dass es gibt.
Verweise
- Chang, R. 2013. Chemie. 11va. Auflage. MC Graw Hill Education.
- Cobian, J. Das Standardpartikelmodell. Erholt von: sne.Ist.
- Fernández de Sala, P. Elementarpartikel, zusammengesetzte Partikel und virtuelle Partikel. Erholt von: ific.UV.Ist.
- Giambattista, a. 2010. Physik. 2. Ed. McGraw Hill.
- Olmo, m. Protonen und Neutronen. Erholt von: Hyperphysik.Phy-astr.GSU.Edu.

