Pepsinogenstruktur, Funktionen, Typen, Synthese
- 756
- 95
- Frederike Birkemeyer
Er Pepsinogen Es ist das Zimogen des Pepsins, eines der wichtigsten hydrolytischen Enzyme, die für die Durchführung der Proteinverdauung im Säugetiermagen zuständig sind. Zimogene oder Proenzyme sind inaktive enzymatische Vorläufer, dh sie können die von ihren aktiven Formen durchgeführten Reaktionen nicht katalysieren.
Seine Aktivierung hängt von Änderungen der dreidimensionalen Struktur des Proteins ab, die zur Bildung eines funktionellen aktiven Zentrums führen. Diese Veränderungen stimmen in den meisten Fällen mit dem proteolytischen Bruch eines Proteinsegments zusammen.
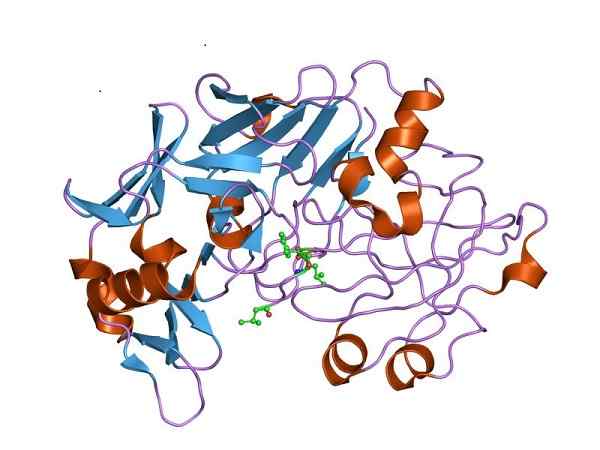
 Dreidimensionale Struktur von Pepsin, der katalytisch aktiven Form von Pepsinogen. Von Jawahar Swaminathan und MSD -Mitarbeitern des Europäischen Bioinformatikinstituts [Public Domain (https: // CreativeCommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons
Dreidimensionale Struktur von Pepsin, der katalytisch aktiven Form von Pepsinogen. Von Jawahar Swaminathan und MSD -Mitarbeitern des Europäischen Bioinformatikinstituts [Public Domain (https: // CreativeCommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons Daher muss Pepsinogen strukturelle Veränderungen erleben, um die erforderliche Peptidaseaktivität zu erwerben und die Proteinverdauung im Magen nach der Nahrungsaufnahme zu begünstigen.
[TOC]
Struktur
Pepsinogen ist ein 371 Aminosäure -Protein, das zur großen Familie astrierischer Proteinasen gehört, die durch die Darstellung von Asparaginsäureresten in seinem aktiven Zentrum gekennzeichnet ist.
Seine quaternäre Struktur wurde zum ersten Mal für das in Schweinen exprimierte Protein durch die X -Ray -Kristallography -Technik bestimmt. Das Ergebnis war ähnlich wie bei der reifen oder aktiven Form des Proteins, des Pepsins.
Der einzige gefundene Unterschied ist daher das Vorhandensein im Pepsinogen eines 44 Aminosäure -Peptids, das sich über die Spalte des aktiven Zentrums faltet. In dieser Position behindert es die Wechselwirkung dieser Protease mit zu verschlechterten Proteinen.
Dieses Peptid, das geklebt wird, um das aktive Enzym hervorzurufen, befindet sich am Amino -Endende des Proteins.
Da es nur als CAP fungiert. Im Gegenteil bleibt dies mit der gleichen Konformation in beiden Formen des Enzyms.
Kann Ihnen dienen: Glucans: Struktur, Eigenschaften und FunktionenIn diesem Sinne ist erwähnenswert.
Funktionen
Zu Beginn des Lebens ist Pepsin (aktive Form von Pepsinogen) für die Milchverdauung wichtig. Anschließend ist es seine Funktion, Diätproteine in ihren Bestandteilen (Aminosäuren) abzubauen, um ihre einfache Absorption zu erleichtern.
Synthese und Sekretion
Pepsinogen wird von den Hauptzellen und Fundikzellen der Magenschleimhaut synthetisiert. Anschließend wird es in sekretorischen Vesikeln gespeichert, die im Zytoplasma dieser Zellen bleiben, bis zu dem Moment, in dem ihre Freisetzung erforderlich ist.
Daher ist die Sekretion dieses Zimogens ein regulierter Prozess. Die Freisetzung von Vesikeln, Bewohner von Cytosol durch Exozytose, benötigt hormonelle und neuronale Reize. Die Zunahme der Magenenzyme, die die Spiegel der Magenszyme absondern und Gastrin, sowie Acetylcholin, Cholecystochin, epidermaler Wachstumsfaktor und Stickoxid stimulieren ihre Synthese und Sekretion.
Zusätzlich haben Experimente mit ATT20 -Zellen, einer Zelllinie, die häufig bei der Untersuchung von Sekretionsstraßen bei Säugetieren verwendet wird.
Zusätzlich zu seiner normalen Sekretion auf Magenniveau wurde sowohl im Blut als auch im Urin eine relativ geringe Menge an Pepsinogen festgestellt, weshalb es Uropepsinogen bezeichnet wurde.
Der Ursprung des Uropepsinogens sowie die Funktion, die es an beiden Orten ausführen kann, bleibt ohne bestimmt zu werden. Ihre Abwesenheit bei Patienten, die den Magen vollständig entfernt haben.
Leute
Bisher wurden zwei Haupttypen von Pepsinogen beschrieben: Pepsinogen I und Pepsinogen II. Beide Typen weisen keine Unterschiede in ihrer katalytischen Aktivität auf und werden durch proteolytische Hydrolyse gleichermaßen aktiviert von Salzsäure abhängen.
Kann Ihnen dienen: Protein -Denaturierung: Was ist, Faktoren, KonsequenzenPepsinogen I wird sowohl von den Hauptzellen als auch von den Fundszellen der Magenschleimhaut synthetisiert und getrennt. Daher nimmt seine Sekretion bei Patienten mit atrophischer chronischer Gastritis ab, eine Magenerkrankung, die durch das Gesamtverschwinden von Magendrüsen gekennzeichnet ist.
Im Gegensatz zu letzterem wird Pepsinogen II (PGII) von praktisch allen Zellen synthetisiert.
Bei Patienten mit atrophischer chronischer Gastritis kompensiert diese Art von Pepsinogen die Abnahme der Pepsinogensekretion I.
Die Existenz dieser beiden Arten von Pepsinogen, die sich nur durch sekretierte Zellen unterscheiden, könnte überflüssig erscheinen. Es kann jedoch eine evolutionäre Anpassung sein, um die Pepsin -Synthese bei Bedarf zu gewährleisten.
Aktivierung
Pepsinogen erwirbt die katalytische Aktivität, wenn sie in Pepsin, Produkt der Eliminierung des 44 Aminosäurepeptids, in der Hohlraum der aktiven Zentrum vorhanden ist, umgewandelt.
Der optimale Betrieb hängt von niedrigen pH -Werten ab, die im Bereich von 1,5 bis 2 enthalten sind. Unter physiologischen Bedingungen werden diese Werte durch die Sekretion von Salzsäure in intrazellulären Kanälen aufrechterhalten.
Die Säureverdauung auf Magenebene findet bei allen Tieren nicht statt, da dies ein Beispiel dafür ist. Wirbeltiere mit Magen, wenn sie eine Peptische Aktivität haben.
Pepsinogen, das in den sekretorischen Vesikeln der Hauptzellen gespeichert ist, wird bei Bedarf an den Magenkanal freigesetzt. Sobald es den Magen erreicht, wird es Pepsin -Produkt der sauren Umgebung und diese aktiveren pepsinogenischen Moleküle.
Durch Wirkung von intrinsischen Nervenfasern und vagaler extrinsischer Stimulation wird die Pepsinogenproduktion sowie HCl, Gastrin und Histamin stimuliert. Andererseits stimulieren Histamin und Gastrin die parietalen Zellen, um HCl abzuziehen.
Kann Ihnen dienen: leitfähige Stoffe: Was ist, Merkmale, FunktionenPepsin wirkt, wie alle Endopeptidase.
Mit anderen Worten; Hydrolysiert die inneren Peptidbindungen eines Proteins. Seine Wirkung ist in Peptidverbindungen in der Nähe von aromatischen Aminosäuren (Phenylalanin, Tyrosin) wirksamer. Im Gegensatz zu seinem Vorläufer -Zimogen erzeugen die adaptiven Veränderungen des Pepsins in pH -Werten von mehr als 6 irreversible Rückgänge der katalytischen Aktivität.
Verweise
- Bryksa BC, Tanaka T, Yada Ry. Die N-terminale Modifikation erhöht die neutrale Stabilität von Pepsin. Biochemie. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Vergleich der primären Strukturen der sauren Protessa und ihrer Zymogene. Adv exp med biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Lehrbuch der medizinischen Phisiologie. (11. Ausgabe.). USA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S., Jameson J. (2005). Harrison, Prinzipien der Inneren Medizin. (16. Ausgabe.). Mexiko: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Schwere atrophische Gastritis mit Helicobacter -Pylori -Infektion und Magenkrebs. Magenkrebs. 1998; 1: 118-124.
- Lin y, fand M, Lin X, Hartsuck JA, Tang J. pH-Abhängigkeit der kinetischen Parameter von Pepsin, Rhizopuspesin und ihren Wasserstoffbrückenbindungsmutanten im aktiven Ort. J Biol Chem. 1992; 267: 18413-18418.
- Mangat p. Säuresekretion und Membran -Reorganisation in einzelnen Magen -Parietalzellen in der Primärkultur. Biologiezelle. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Entwicklung der Magensekretionsfunktion. Fötal und Neugeborenenphysiologie (fünfte Ausgabe). Band 1, Seiten 881-888.
- Schubert ML. Magengeheimnis. Aktuelle Opin Mastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James Mng. Die molekularen und Kristallstrukturen von monoklinem Schweinepepsin, das bei 1 verfeinert wurde.8 Å Auflösung. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Henglels KJ, Moller H, Newell DG, Palli D, Elder JB. Die Epidemiologie von Pepsinogen A -Spiegeln mit niedrigem Serum und internationaler Zusammenarbeit mit Magenkrebsraten. Gastroenterologie. 1994; 107: 1335-1344.
- Wolfe MM, Soll Ah. Die Physiologie des Magensäuregeheimnisses. N English J Med 1998; 319: 1707.
- « G -Zellenentwicklung, Gastrin, Torf -Tippfehlerkanäle
- Nanche -Eigenschaften, Lebensraum, Eigenschaften, Kochrezepte »

