Kaliumpermanganat (KMNO4)

- 4481
- 968
- René Riediger
 Kaliumpermanganatkristalle
Kaliumpermanganatkristalle Was ist Kaliumpermanganat?
Er Kaliumpermanganat (Kmno4) Es handelt. Es ist ein dunkelviolettes Glasfest. Seine wässrigen Lösungen sind auch dunkelviolett; Diese Lösungen werden weniger violett, da sie in großen Wassermengen verdünnt sind.
Kommerziell wird in Präsentationen von Tabletten, Kristallen und Staub erreicht. Es ist mit den Namen von Condy oder Mineral Camaleón bekannt. Der Begriff "Chamäleon" spielt auf die Fähigkeit des Minerals an: Wenn er die Farbe in Kontakt mit ätzender Soda und organischer Substanz ändert, tritt Zucker auf.
Der KMNO4 Es beginnt in einer Reihe von Farben in der folgenden Reihenfolge Reduzierungen (Gewinnelektronen) zu leiden2). Diese Reaktion zeigt eine wichtige Eigenschaft von Kaliumpermanganat: Es ist ein sehr starkes Oxidationsmittel.
Formel
Seine chemische Formel ist kmno4; Das heißt für jedes Kation k+ Es gibt einen Anion Mno4- mit diesem interagieren
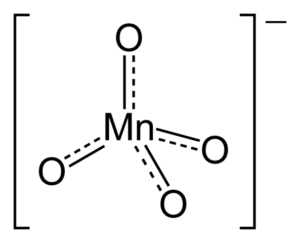
Chemische Struktur von Kaliumpermanganat
 Kristalline Struktur von kmno4
Kristalline Struktur von kmno4 Im oberen Bild wird die kristalline Struktur des KMNO dargestellt4, Welches ist ortorrombischer Typ. Lila Kugeln entsprechen Kationen+, Während das Tetraeder, das von den vier roten Kugeln und der bläulichen Kugel gebildet wird, entspricht dem Anion Mno4-.
Warum hat Anion eine tetraedrische Geometrie? Seine Lewis -Struktur beantwortet diese Frage. Die gepunkteten Linien bedeuten, dass die doppelten Verbindungen zwischen dem Mn und dem O resonieren. Um diese Struktur zu übernehmen, muss das Metallzentrum eine Hybridisierung haben sp3.

Da Mangan ungewöhnliche Elektronenpaare fehlt, werden Mn-O-Bindungen nicht in Richtung derselben Ebene gedrückt. Ebenso ist die negative Belastung auf die vier Sauerstoffatome verteilt und ist für die Ausrichtung der K -Kationen verantwortlich+ Innerhalb kristalline Anordnungen.
Kann Ihnen dienen: IonisationskonstanteKmno verwendet4
Medizin und Tierarzt
Aufgrund seiner bakteriziden Wirkung wird es bei zahlreichen Krankheiten und Erkrankungen verwendet, die Hautläsionen verursachen, wie z.
Aufgrund seiner schädlichen Wirkung muss Kaliumpermanganat bei niedrigen Konzentrationen (1: 10000) verwendet werden, was die Wirksamkeit seiner Wirkung begrenzt.
Es wird auch bei der Behandlung von Fischparasitose in Aquarien verwendet, die Infektionen von Hautdarm und Geschwüren erzeugen.
Wasserversorgung
Es handelt sich um eine chemische Regeneration, die zum Entfernen von Eisen, Magnesium und Wasserstoffsulfid aus dem Wasser (eines unangenehmen Geruchs) verwendet wird, um das Abwasser zu reinigen.
Eisen- und Magnesiumniederschlag in Form seiner unlöslichen Wasseroxide. Darüber hinaus hilft es, den in den Rohren vorhandenen Rost zu entfernen.
Fruchtkonservierung
Kaliumpermanganat entfernt die in den Bananen während der Lagerung erzeugte Ethylen.
In Afrika nutzen sie es, um Gemüse zu genießen, um jegliches gegenwärtiges Bakterienmittel zu neutralisieren und zu beseitigen.
Feueraktion
Kaliumpermanganat wird zur Begrenzung der Brandverlängerung verwendet. Basierend auf der Fähigkeit des Permanganats, Feuer zu starten.
Redox -Titel
In der analytischen Chemie werden seine standardisierten wässrigen Lösungen als Oxidationsmittel -Titel bei Redoxbestimmungen verwendet.
Organisches Reagenz
Es dient dazu, Alkene in Diolen umzuwandeln; Das heißt, zwei OH -Gruppen werden zur Doppelbindung c = c hinzugefügt. Die folgende chemische Gleichung:

Auch in Schwefelsäurelösung mit Chromsäure (H)2Cro4) Es wird zur Oxidation von Primäralkoholen (R-OH) auf Carbonsäuren (R-CoOH oder RCO2H).
Kann Ihnen dienen: nicht -polare kovalente BindungSeine oxidierende Kraft ist stark genug, um die primären oder sekundären Alkylgruppen der aromatischen Verbindungen "Carboxyling sie" zu oxidieren. das heißt, die Seitenkette R zu verwandeln (zum Beispiel ein Cho3) In einer Cooh -Gruppe.
Historische Verwendungen
Es war Teil der Pulver, die in der Fotografie als Blitz verwendet wurden oder um die Termite -Reaktion zu beginnen.
Es wurde im Zweiten Weltkrieg für die Tarnung weißer Pferde während des Tages verwendet. Dafür benutzten sie Mangan -Dioxid (MNO2), was braun ist; Auf diese Weise gingen sie unbemerkt.
KMNO -Synthese4
Das Pyrolusit -Mineral enthält Mangandioxid (MNO2) und Kaliumcarbonat (Caco3).
1659 der Chemiker Johann R. Glauber schmolz das Mineral und löste es in Wasser auf, beobachtete das Erscheinungsbild einer grünen Färbung in der Lösung, die sich später in violettem Farben und schließlich zu Rot änderte. Diese letzte Farbe entsprach der Erzeugung von Kaliumpermanganat.
Im Mid -Nineteenth -Jahrhundert suchte Henry Condy ein antiseptisches Produkt und behandelte zunächst den Pyrolusit mit NaOH und später mit Koh, wobei die sogenannten Kondykristalle produzierten; das heißt Kaliumpermanganat.
Kaliumpermanganat wird industriell aus Mangandioxid hergestellt, die im Pyrolusitmineral vorhanden sind. Der Mno2 in den Mineralreaktionen mit Kaliumhydroxid vorhanden und anschließend in Gegenwart von Sauerstoff erhitzt.
2 Mno2 + 4 Koh +oder2 => 2 k2Mne4 + 2 h2ENTWEDER
Kaliummanganat (K. K2Mne4) wird durch elektrolytische Oxidation in ein alkalisches Medium in Kaliumpermanganat umgewandelt.
2 k2Mne4 + 2 h2O => 2 kmno4 + 2 Koh +H2
In einer weiteren Reaktion zur Herstellung von Kaliumpermanganat wird Kaliummanganat mit CO reagiert2, Beschleunigung des Missverhältnisses:
3 k2Mne4 + 2 co2 => 2 kmno4 + Mne2 + K2CO3
Kann Ihnen dienen: Molekulare OrbitalentheorieAufgrund der Erzeugung des MNO2 (Mangandioxid) Der Prozess ist ungünstig, KOH muss aus K erzeugt werden2CO3.
Eigenschaften von KMNO4
Es handelt.
Es ist nicht sehr löslich in Wasser (6,4 g/100 ml bei 20 ° C), was darauf hinweist, dass Wassermoleküle die MNO -Ionen nicht weitgehend lösen4-, Weil ihre tetraedrischen Geometrien vielleicht viel Wasser für ihre Auflösung erfordern. In ähnlicher Weise kann es sich auch in Methylalkohol, Aceton, Essigsäure und Pyridin lösen.
Zersetzung
Es zersetzt sich bei 240 ° C und freisetzt Sauerstoff:
2kmno4 => K2Mne4 + Mne2 + ENTWEDER2
Sie können eine Zerlegung durch die Wirkung von Alkohol und anderen organischen Lösungsmitteln sowie durch die Wirkung starker Säuren und Reduktionsmittel erleben.
Oxidierende Kraft
In diesem Salz zeigt der Mangan seinen größten Oxidationszustand (+7) oder was gleich ist, zu der maximalen Menge an Elektronen, die es auf ionische Weise verlieren kann. Die elektronische Mangankonfiguration ist wiederum 3D54S2; Daher ist in Kaliumpermanganat die gesamte Valencia -Schicht des Mangansatoms "leer".
Dann präsentiert das Manganatom die natürliche Tendenz, Elektronen zu gewinnen; Das heißt, reduziert auf andere Oxidationszustände in alkalischen oder sauren Medien. Dies ist die Erklärung, warum kmno4 Es ist ein starkes Oxidationsmittel.
Verweise
- F.Albert Cotton und Geoffrey Wilkinson, FRS. (1980). Fortgeschrittene anorganische Chemie. Editorial Limusa, Mexiko, 2. Ausgabe, Seite 437-452.
- Robin Wasserman. Medizinische Anwendungen für Kaliumpermanganat. Livestrong erholte sich.com
- Clark d. Die 3 ultimativen Anwendungen von Kaliumpermanganat. Von Technologie erholt.Org
- J.M. Cedardea, c. Arnáiz und e. Díaz. Kaliumpermanganat: ein starkes und vielseitiges Oxidationsmittel. Abteilung. Chemie- und Umwelttechnik. Universitätsschule von Sevilla.

