Wasserstoffperoxid (H2O2) -Struktur, Eigenschaften, Verwendungen, erhalten

- 1596
- 71
- Jasmine Kupprion
Er Wasserstoffperoxid Es ist eine anorganische Verbindung, deren chemische Formel H ist2ENTWEDER2. Jeder ist das einfachste Peroxid dieser Familie chemischer Verbindungen. Seine strukturelle Formel ist H-O-O-H, diese innere Sauerstoffbrücke ist charakteristisch für alle Peroxide.
Im Jahr 1818 h2ENTWEDER2 Es wurde von Louies Jacques Thénard identifiziert, der eine chemische Verbindung vorbereitete, die er damals Huzigenada forderte. Es ist eine instabile Verbindung, die sich durch Licht, Wärme und einige Metalle zersetzt.
 Chemische Formel von Wasserstoffperoxid
Chemische Formel von Wasserstoffperoxid Es ist eine sehr nützliche Verbindung, die bei der Desinfektion kleinerer Wunden, Haarbleiche, Wasserbehandlung usw. verwendet wird. Obwohl er schädliche Handlungen für das menschliche Wesen haben kann, findet es in allen eukaryotischen Zellen von Lebewesen, wo er mehrere vorteilhafte Funktionen ausführt.
Wasserstoffperoxid erzeugt die Oxidation toxischer Substanzen wie Phenole, Ethanol, Formaldehyd usw., Produkte, die von Leber und Nieren beseitigt werden. Darüber hinaus trägt es zur Zerstörung der von Neutrophilen und Makrophagen -Leukozyten phagozierten Bakterien bei.
[TOC]
Struktur
Molekül
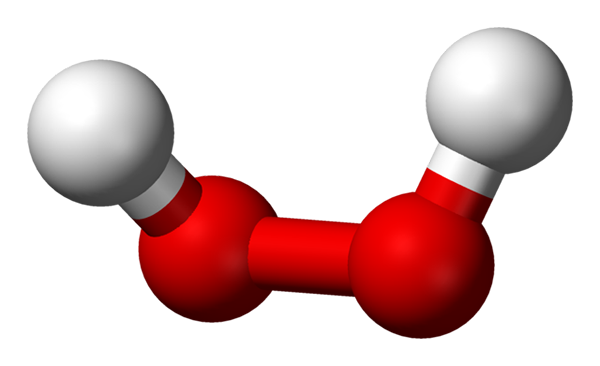 Wasserstoffperoxidmolekül, das mit einem Kugeln und Balkenmodell dargestellt wird. Quelle: Benjah-BMM27 über Wikipedia.
Wasserstoffperoxidmolekül, das mit einem Kugeln und Balkenmodell dargestellt wird. Quelle: Benjah-BMM27 über Wikipedia. Im überlegenen Bild ist die Struktur des H -Moleküls zu sehen2ENTWEDER2 (H-O-O-H) mit den roten Kugeln, die Sauerstoffatomen und weißen Wasserstoffatomen entsprechen. Beachten Sie, dass das Molekül nicht flach ist und dass weder die Atome H im Weltraum in den Schatten gestellt sind (einer vor dem anderen).
Interessanterweise zu h2ENTWEDER2 Es ist schwierig, seine einfache zentrale Verbindung O-O zu drehen, daher können die Positionen dieser H nicht ausgetauscht werden. Einer wird nicht untergehen, während der andere aufgeht.
Weil? Denn in den beiden Sauerstoffatomen gibt es zwei elektronenfreie Paare, was insgesamt acht sehr enge Elektronen ergibt und sich gegenseitig für ihre negativen Ladungen abweist.
Rotationen
Trotzdem dürfte sich die O-O-Verbindung aufgrund von Wechselwirkungen mit seiner Umgebung drehen.
Zum Beispiel, wenn zusammen mit den beiden Daumen, die die Finger verlängert und die anderen geschlossen haben, wie z. B. das Zeichnen eines Gerichts ungefähre Darstellung von h2ENTWEDER2.
Wenn ein Körper eines der Indizes spielt, drehen sich die Daumen als Reaktion auf diese Wechselwirkung. Sie werden jedoch aufgrund der oben genannten elektronischen Abstoßungen sofort in ihre ursprüngliche Position zurückkehren. Diese Rotationen rahmen die dynamischen Aspekte dieses Moleküls ein.
Intermolekulare Wechselwirkungen
In dem flüssigen Zustand die h2ENTWEDER2 schafft es, Wasserstoffbrücken zu etablieren (hooh-o2H2), sonst würde sein hoher Siedepunkt (150 ° C) im Vergleich zum Wasser nicht erklärt werden.
Kann Ihnen dienen: Calciumsulfat (Fall4): Chemische Struktur, Eigenschaften, verwendetSobald es in die Gasphase übergeht, sind die M -Moleküle2ENTWEDER2 Vermutlich können solche Brücken nicht mehr zu den größten intermolekularen Entfernungen bilden, sondern auch die Wasserstoffatome wären die ersten, die bei Kollisionen berührt werden (dies kann durch Rückdrehen zum Fingers -Modell sichtbar gemacht werden).
In der festen Phase beträgt der Winkel der Ebenen, die das H festlegen, 90 ° (die senkrechten Finger setzen) Finger). Jetzt werden Wasserstoffbrücken noch wichtiger und H -Moleküle2ENTWEDER2 Sie werden in einem tetragonalen Strukturkristall bestellt.
Eigenschaften
Sbotella mit Wasserstoffperoxid. In Apotheken wird es mit einer Konzentration von 3% m/V erreicht. Quelle: Pixnio.
Namen
-Wasserstoffperoxid
-Dioxidano
-Oxidanol
-Perhydoxinsäure
-O-Hydroxyol
-Wasserstoffperoxid
Molmasse
34.0147 g/mol
Aussehen
Hellblau (konzentriert) oder farblos. Es ist etwas viskoser und dichter als Wasser. Es wird für Sicherheit bei niedrigen Temperaturen und reduziertem Druck destilliert, da es sich durch explosionsartiges Erhitzen zersetzt.
Geruch
Akut oder ein Geruch ähnlich wie Ozon.
Geschmack
Bitter
Dichte
Solide 1,71 g/cm3
Die Dichten ihrer wässrigen Lösungen hängen von ihrer Konzentration ab; Zum Beispiel haben 27 % eine Dichte von 1,10 g/cm3, während 50 %1,13 g/cm3
Schmelzpunkt
- 0,43 ºC
Siedepunkt
150,2 ºC. Dieser Wert wurde durch Extrapolation erhalten, da Wasserstoffperoxid bei hohen Temperaturen zersetzt.
Wasserlöslichkeit
Mischbar ≥ 100 mg/ml bei 25 ° C
Löslichkeit
Es ist in Äther und Alkoholern löslich, aber in Ölether unlöslich. Es zersetzt sich in Wasser und Sauerstoff in vielen organischen Lösungsmitteln.
Oktanol/Wasserpartitionskoeffizient
Log p = - 0,43
Dampfdruck
5 mmHg bei 30 ° C.
Dissoziationskonstante
PKA = 11,72
pH
Wasserstoffperoxidlösungen sind leicht sauer. Zum Beispiel hat ein bis 35% einen pH -Wert von 4,6; Aber bei der Konzentration bei 90%wird der pH -Wert weniger sauer: 5,1.
Brechungsindex (nD)
1.4061
Schmiere
1.245 CPOISE bei 20 ° C.
Wärmekapazität
1,267 J/G · K (Gas)
2.619 J/G · K (Flüssigkeit)
Verdampfungswärme
1,519 j/g · k
Stabilität
Stabil unter den empfohlenen Bedingungen. Die Zugabe von Acetanylid und Zinnsalzen stabilisieren es mehr.
Korrosion
Ätzend
Zersetzung
Es zersetzt sich durch Lichtbelastung oder in Gegenwart oxidierender und reduzierender Substanzen. Es wird auch durch Erwärmung zerbrochen. Wenn es beschlagnahmt wird, wird Wasser und Sauerstoff freigesetzt und durch einen Anstieg von pH und Temperatur sowie mit dem Vorhandensein des Catlase -Enzyms bevorzugt.
Kann Ihnen dienen: Natriumperoxid (Na2o2): Struktur, Eigenschaften, verwendetOberflächenspannung
80,4 Dins/cm a 20 ºC
Reaktivität
Die h2ENTWEDER2 Es wirkt als Oxidationsmittel in sauren Lösungen von Eisen Eisen (Faith2+) Eisen Eisen (f)3+); Oxidieren Sie auch Sulfition (so32-) zu sulfation (so42-).
Es kann auch als Reduktionsmittel in Gegenwart grundlegend4) Mit Sauerstofffreisetzung.
Anwendungen
Whitening
Wasserstoffperoxid wird in der Papierindustrie zum Bleichen von Zellstoff und Papier verwendet, das den größten Teil seiner jährlichen Produktion verbraucht.
Desinfektionsmittel
Wasserstoffperoxid ist ein sanftes Antiseptikum, um kleine Wundinfektionen, Kratzer und Verbrennungen zu vermeiden. Es wird auch als Mundspülung verwendet und milde Mundreizungen aufgrund des Vorhandenseins von Mundbuchten oder Gingivitis lindern.
Es wird auch verwendet, um Oberflächen, das Innere von Kühlschränken, Wasser und übermäßiges Bakterienwachstum in Wassersystemen und Kühltürmen zu desinfizieren. Wasserstoffperoxid freisetzt sauerstofffreie Radikale, die Schadstoffe zersetzen.
Waschmittel
Wasserstoffperoxid wird zur Herstellung von Whitinging -Detergenzien der Kleidung verwendet, einschließlich Natriumcarbonat. Diese Verbindung ist ein Komplex aus Natriumcarbonat und Wasserstoffperoxid, der im Wasser getrennt in seinen Komponenten gelöst ist.
Kosmetische Anwendung
Verdünnter Wasserstoffperoxid wird vor der Färbung beim Haarbleichmittel verwendet. Es wird auch verwendet, um die Zähne als Teil einer hausgemachten Zahncreme zu blleichen.
Treibmittel
Wasserstoffperoxid wird als Monoporziermittel oder oxidierende Komponente einer bipropoonösen Rakete verwendet. Es bricht die Freisetzung von Sauerstoff und Wasser auf, ein Merkmal, das seine Verwendung als Treibmittel ermöglichte.
Eine Reaktionszelle wird mit dem Vorhandensein eines Katalysators gepumpt, der die Zersetzung beschleunigt. Währenddessen wird Wasserdampf bei hoher Temperatur erzeugt.
Wenn Dampf durch eine Lücke ausgestoßen wird, erzeugt er einen Impuls. Das 1940 gebaute V-80-U-Boot, das in den aus Wasserstoffperoxid erzeugten Sauerstoffturbinen verwendet wurde; genannt Walter Turbine System.
Erhalten
Anfänglich wurde Wasserstoffperoxid industriell durch Hydrolyse von Ammoniumpersulfat erhalten [(NH)4)2S2ENTWEDER8] oder die Elektrolyse von Ammonium Bisulfat, NH4HSO4.
Wasserstoffperoxid wird industriell durch die Verwendung von Antraquinon erhalten. Das Verfahren wird in vier Stadien durchgeführt: Hydrierung, Filtration, Oxidation, Extraktion und Reinigung.
Kann Ihnen dienen: Magnesiumfluorid: Struktur, Eigenschaften, Synthese, verwendetHydrierung
Alquilantroquinona wird durch die Durchführung von Wasserstoffgas durch einen mit Aluminiumoxid beladenen Wasserstoffgas und eine geringe Menge des Katalysators (Paladium) hydriert. Die Temperatur wird bei 45 ° C bei dauerhafter Bewegung gehalten.
Das Alkyndrochinon wird in Alquiloantrahydroquinona und die Tetrahydroalquilantrahydroquinon umgewandelt, die letztere für seine größte Bequemlichkeit für die folgenden Verfahren auswählt.
Filtration
Die Lösung enthielt.
Oxidation
Die gefilterte Lösung oxidiert durch die Luft durch sie und bildet mit geringer Reinheit von Wasserstoffperoxid.
Extraktion und Reinigung
Die Lösung mit Wasserstoffperoxid kreuzt eine Flüssigkeits-Flüssig-Extraktionssäule. Wasser fließt durch die Säule, während die Lösung mit Wasserstoffperoxid dadurch gepumpt wird.
Das Wasser erreicht den Boden des Extraktors mit einer Konzentration von Wasserstoffperoxid zwischen 25 und 35 % P/P. Dann wird es durch Vakuumdestillation auf eine 30 % ige Wasserstoffperoxidkonzentration gereinigt. Endlich stabilisiert und gelagert.
Risiken
 Wasserstoffperoxid Verbrennung. Quelle: Bobjgalindo [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Wasserstoffperoxid Verbrennung. Quelle: Bobjgalindo [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Wasserstoffperoxid ist ein ätzendes Mittel, daher erzeugt der Hautkontakt zu schweren Reizungen, zusätzlich zum vorübergehenden Aufweichen (überlegenes Bild). Es kann auch Augenschäden, Juckreiz, Spalt, Rötung und Ampullenbildung verursachen.
Seine Inhalation erzeugt Reizungen in Nase, Hals und Lungen. In der Zwischenzeit kann eine wiederholte Exposition zu Bronchitis, Husten, Schleim und Atemverkürzung führen. Und als ob es nicht genug wäre, erzeugt es auch Kopfschmerzen, Vahid, Übelkeit und Erbrechen.
Eine schwerwiegende Exposition gegenüber Wasserstoffperoxid kann in der Lunge Flüssigakkumulation erzeugen.
Die Arbeitsschutzverwaltung (OSHA) hat in einem Arbeitsumfeld in einem 8 -stündigen Tag das maximal zulässig für Wasserstoffperoxid von 1 ppm zulässig. Da es sich jedoch um eine mutagene Verbindung handelt, muss die Exposition gegenüber dem Minimum verringert werden.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Wasserstoffperoxid. Abgerufen von: in.Wikipedia.Org
- William r. Busse und Henri a. Erheben. (2004). Kristall- und Molekularstruktur von Wasserstoffperoxid: eine Neutronen -Beugungsstudie. doi.org/10.1063/1.1696379
- Nationales Zentrum für Biotechnologie Information. (2019). Wasserstoffperoxid. Pubchem -Datenbank. CID = 784. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Die Herausgeber von Enyclopaedia Britannica. (27. November 2018). Wasserstoffperoxid. Encyclopædia Britannica. Erholt von: Britannica.com
- Das Gesundheitsministerium in New Jersey. (2016). Wasserstoffperoxid. [PDF]. Erholt von: NJ.Regierung
- Mathews, c. K., Van Holde, K. UND., Ahern, k. G. (2002). Biochemie. Dritte Edition. Pearson Addison Wesley Editorial
- MD Web. (2019). Wasserstoffperoxid. Abgerufen von: webmd.com
- « Aztekische Medizingeschichte, Gott, Pflanzen, Krankheiten
- Zinkoxid (ZnO) Struktur, Eigenschaften, Verwendung, Risiken »

