Piperidinstruktur, Synthese, Derivate, Reaktionen
- 2280
- 84
- Joe Hartwig
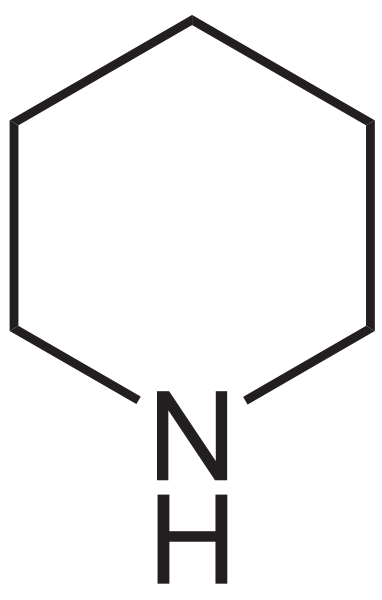
Der Piperidin Es ist eine organische Verbindung, deren kondensierte Formel ist (ch2)5NH. Es besteht aus einem zyklischen sekundären Amin.
Piperidin wird zur nitrogenen Version des Cyclohexan. Beachten Sie beispielsweise im unteren Bild die strukturelle Formel von Piperidin: Sie ist dem des Cyclohexan sehr ähnlich, mit dem einzigen Unterschied, dass eine der Methylengruppen, Cho2, wurde durch ein NH ersetzt.
 Strukturformel von Piperidin. Quelle: Neurotoger / Public Domain
Strukturformel von Piperidin. Quelle: Neurotoger / Public Domain Der merkwürdige Name dieses Amin stammt aus dem lateinischen Wort "Piper", was Pfeffer bedeutet, weil es sich im schwarzen Pfeffer befand, wo es zum ersten Mal gefunden und synthetisiert wurde. Tatsächlich wird das Aroma von Piperidin durch das einer Mischung aus Pfeffer und Fisch verwirrt.
Der sechseckige und heterocyclische Ring ist auch in vielen Alkaloiden und Medikamenten dargestellt, sodass Piperidin für die organische Synthese solcher Produkte bestimmt ist. wie Morphium, minexidil und die mögliche Weise.
[TOC]
Struktur
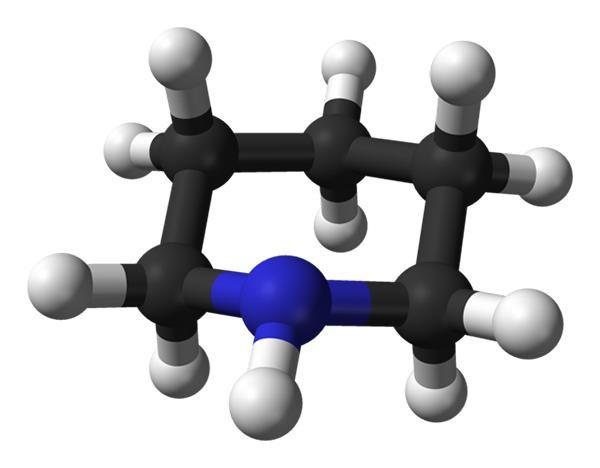 Piperidinmolekulare Struktur. Quelle: Benjah-BMM27 / Public Domain
Piperidinmolekulare Struktur. Quelle: Benjah-BMM27 / Public Domain Im oberen Bild haben wir die molekulare Struktur des Piperidins, dargestellt durch ein Modell von Kugeln und Stäben. Die schwarzen Kugeln, die den Kohlenstoffatomen entsprechen, bilden das Skelett, das dem Cyclohexan gleich wäre, wenn es nicht für das Stickstoffatom ist, das der bläulichen Kugel.
Hier sehen Sie die fünf Methyleneinheiten, CH2, und die Art und Weise, wie ihre Wasserstoffatome angeordnet sind. Ebenso ist die sekundäre Aminogruppe deutlich beobachtet, deren elektrischer Stickstoff die Polarität zum Molekül beiträgt.
Kann Ihnen dienen: Vorteile der Chemie für die GesellschaftDaher hat Piperidin ein dauerhaftes Dipolmoment, in dem die negative Lastdichte um NH konzentriert ist.
Durch das Piperidin ist ein Dipolmoment, seine intermolekularen Kräfte oder Wechselwirkungen sind überwiegend vom Dipol-Dipolo-Typ.
Unter den Dipolo-Dipolo-Wechselwirkungen sind die Wasserstoffbrücken vorhanden. Infolge.
Konformationen
Der sechseckige Ring des Piperidins ist ebenso wie der des Cyclohexan nicht flach: Seine Wasserstoffatome wechseln sich in axialen Positionen (oben oder unten) und äquatorial (nach den Seiten gerichtet) ab. Daher nimmt Piperidin mehrere räumliche Konformationen an, wobei der Stuhl der wichtigste und stabilste ist.
Das vorherige Bild zeigt eines der vier möglichen KonFóomere, in denen sich das Wasserstoffatom der NH -Gruppe in der äquatorialen Position befindet; Während sich das Drehmoment der Stickstoff -NICHT geteilten Elektronen in axialer Position befindet (in diesem Fall) (in diesem Fall).
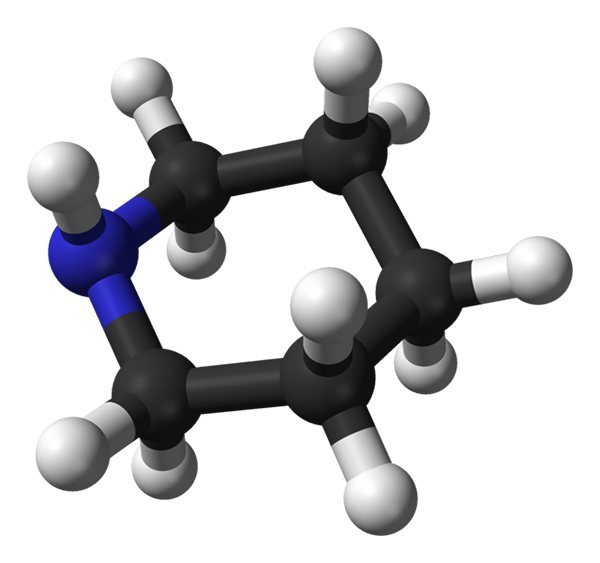 Axiale Konformation von Piperidin. Wasserstoffatom in axialer Position erhöht die Schwesterspannung am Ring, weil sie zu nahe an anderen axialen und benachbarten Wasserdingen liegt. Quelle: Benjah-BMM27 / Public Domain
Axiale Konformation von Piperidin. Wasserstoffatom in axialer Position erhöht die Schwesterspannung am Ring, weil sie zu nahe an anderen axialen und benachbarten Wasserdingen liegt. Quelle: Benjah-BMM27 / Public Domain Jetzt wird ein weiteres Konfruero (überlegenes Bild) gezeigt, in dem diesmal das Wasserstoffatom der NH -Gruppe in axialer Position ist (nach oben); und das Paar von Stickstoff -nicht geteilten Elektronen in äquatorialer Position (nach links).
Insgesamt gibt es vier Konformere: zwei mit dem Wasserstoff von NH in axialen und äquatorialen Positionen und zwei andere, in denen die relativen Positionen der Stickstoffelektronen in Bezug auf den Stuhl variieren.
Kann Ihnen dienen: seleenhydrische Säure (H2SE): Was ist, Struktur, Eigenschaften, verwendetDie Konformere, in denen sich NH -Wasserstoff in äquatorialer Position befindet.
Synthese
Die erste Synthese von Piperidin. Piperin reagiert mit Salpetersäure und löst die heterocyclische Einheit ab, deren Struktur bereits überprüft wurde.
Auf industriellen Skalen wird die Synthese von Piperidin jedoch durch die katalytische Hydrierung des Pyridins bevorzugt:
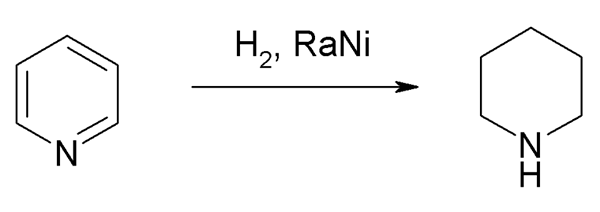 Pyridinhydrierung, um Piperidin zu erhalten. Quelle: Steffen 962 über Wikipedia.
Pyridinhydrierung, um Piperidin zu erhalten. Quelle: Steffen 962 über Wikipedia. Hydogene, h2, Sie schließen sich dem Pyridinring an, das ihr aromatisches System baut, für das die Hilfe von metallischen Katalysatoren benötigt wird.
Derivate
Piperina
Viel wichtiger als Piperidin selbst, ist seine strukturelle Einheit, die in unzähligen Alkaloiden und Substanzen des Pflanzenentwurfs erkennbar ist. Im Folgenden haben Sie beispielsweise die molekulare Struktur des Piperin:
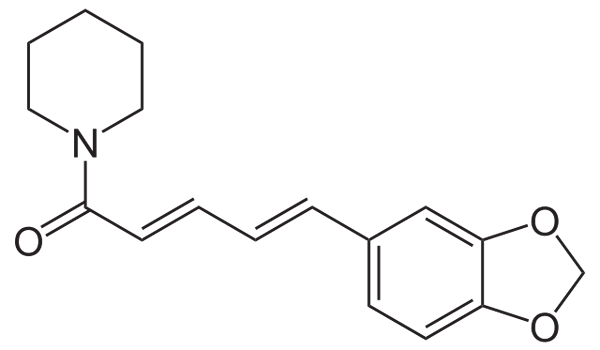 Strukturformel des Piperin. Quelle: Neurotoger über Wikipedia.
Strukturformel des Piperin. Quelle: Neurotoger über Wikipedia. Piperina hat eine stark konjugierte Struktur; Das heißt. Wenn ja, wäre der schwarze Pfeffer giftig.
Coniína
Der heterocyclische und hexagonale Ring des Piperidins ist auch im Coní vorhanden. Seine Struktur ist:
Kann Ihnen dienen: Amides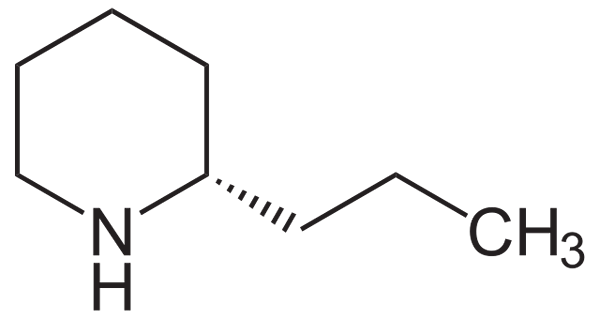 Coniína Strukturformel. Quelle: Neurotoger / Public Domain
Coniína Strukturformel. Quelle: Neurotoger / Public Domain Beachten Sie, dass sich die Coniína durch das Vorhandensein eines Propylsubstituenten im Kohlenstoff neben der NH -Gruppe kaum vom Piperidin unterscheidet.
Somit werden Piperidinderivate erhalten, indem die Hydrogene des Rings oder des Wasserstoffs derselben NH -Gruppe durch andere molekulare Gruppen oder Fragmente ersetzt werden.
Morphium
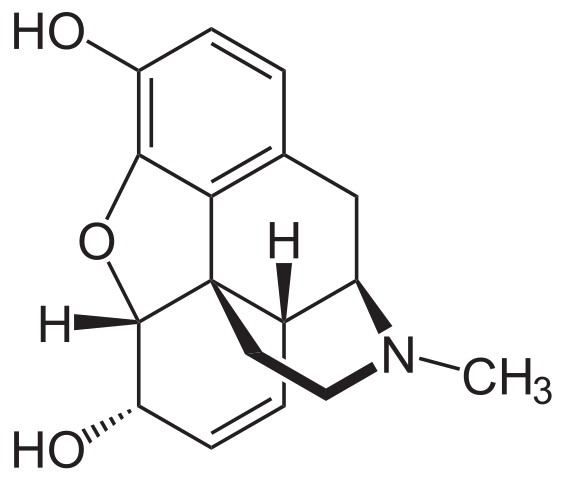 Strukturformel von Morphin. Quelle: Neurotoger / Public Domain
Strukturformel von Morphin. Quelle: Neurotoger / Public Domain Morphin ist ein weiteres natürliches Derivat von Piperidin. Diesmal wird der Piperidinring mit anderen Ringen verschmolzen und zeigt aus der Ebene in Richtung des Beobachters. Es wird identifiziert, weil es einen Link zur CHO -Gruppe bildet3.
Drogen
Piperidin und seine Derivate werden für das Design und die Synthese verschiedener Arten von Arzneimitteln verwendet. Daher sind sie synthetische Derivate von Piperidin. Drei von ihnen werden dann zusammen mit ihren jeweiligen strukturellen Formeln aufgeführt:
 Risperidon, ein atypisches Antipsychotika, das für die Behandlung mehrerer psychischer Störungen verschrieben wurde. Quelle: FVasconcellos (Diskussion • Beiträge) / Public Domain
Risperidon, ein atypisches Antipsychotika, das für die Behandlung mehrerer psychischer Störungen verschrieben wurde. Quelle: FVasconcellos (Diskussion • Beiträge) / Public Domain  Minoxidil, ein Vasodilatator, der normalerweise mit Alopezie umgeht. Quelle: Vaccinationist / Public Domain
Minoxidil, ein Vasodilatator, der normalerweise mit Alopezie umgeht. Quelle: Vaccinationist / Public Domain  Icaridin oder Picaridin, ein Insektenschutzmittel, das die Formulierung der Angebote ausgeht. Quelle: ArrowsMaster/CC BY-S (https: // createRecommons.Org/lizenzen/by-sa/4.0)
Icaridin oder Picaridin, ein Insektenschutzmittel, das die Formulierung der Angebote ausgeht. Quelle: ArrowsMaster/CC BY-S (https: // createRecommons.Org/lizenzen/by-sa/4.0) Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Piperidin. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2020). Piperidin. Pubchem -Datenbank., CID = 8082. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Elsevier b.V. (2020). Piperidin. Scientedirect. Abgerufen von: Scientedirect.com
- Harold d. Banken. (1992). Piperidin -Synthese. [PDF]. Wiederhergestellt von: Apps.DICT.tausend
- « Polyvinylpirrolidonstruktur, Eigenschaften, Verwendungen, Nebenwirkungen
- Silbernitrat (AGNO3) Struktur, Eigenschaften, Verwendungszwecke, Toxizität »

