Pyridinstruktur, Eigenschaften, Verwendung, Toxizität, Synthese
- 767
- 215
- Medine Kedzierski
Der Pyridin Es ist ein aromatisches Amin, dessen chemische Formel C ist5H5N. Es ist die Stickstoffversion von Benzol, da ein Gruppen -Ch = durch ein Stickstoffatom (N) ersetzt wurde. Zusammen mit dem Pyrol bildet das Pyridin die Gruppe einfacherer aromatischer Amine von allen.
Anfangs trat das Pyridin aus dem Hulla -Teer auf, aber es war eine kleine Leistungsmethode. Dies führte zur Schaffung verschiedener Methoden für seine chemische Synthese, die die Reaktion des Formaldehyds, Acetaldehyd und Ammoniaks verwendet hat.
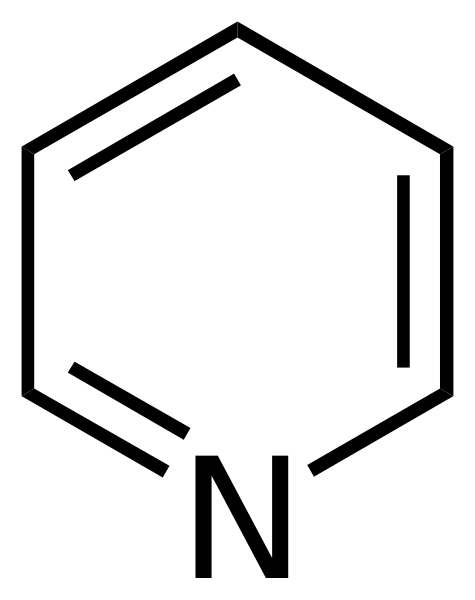 Strukturformel von Pyridin. Quelle: Calvero. / Public Domain
Strukturformel von Pyridin. Quelle: Calvero. / Public Domain Das Pyridin wurde erstmals von Thomas Anderson (1843), einem Chemiker, gewonnen, der durch die Erwärmung von Tierfleisch und Knochen ein Öl produzierte, aus dem das Pyridin gereinigt wurde.
 Thomas Anderson (Juli 1819)
Thomas Anderson (Juli 1819) Pyridin wird als Rohstoff für die Synthese von Verbindungen verwendet, die die Proliferation von Insekten, Pilzen, Kräutern usw. eliminieren und kontrollieren. Es wird auch zur Ausarbeitung zahlreicher Medikamente und Vitamine verwendet, sondern auch als Lösungsmittel verwendet.
Pyridin ist eine toxische Verbindung, die auf chronische Weise die Leber, die Nieren und das Funktionieren des Zentralnervensystems beschädigen kann. Pyridin kann aufgrund von Aufnahme, Inhalation und Verbreitung durch die Haut in den Körper gelangen. Es ist in der Chemikalie bekannt, weil es eine Substanz ist, die bei Männern Hilflosigkeit verursacht.
[TOC]
Pyridinstruktur
Molekular
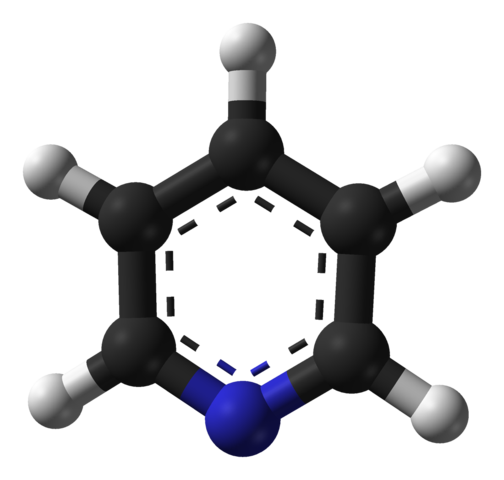 Molekülstruktur von Pyridin. Quelle: Benjah-BMM27 / Public Domain
Molekülstruktur von Pyridin. Quelle: Benjah-BMM27 / Public Domain Das überlegene Bild zeigt die molekulare Struktur des Pyridins, das durch ein Modell von Kugeln und Balken dargestellt wird. Wie zu sehen ist, ist sein Molekül dem von Benzol sehr ähnlich, wobei der einzige Unterschied, dass es eines seiner Kohlenstoffe (schwarze Kugeln) hat, durch Stickstoff (blaue Kugel) ersetzt wird.
Stickstoff zieht, weil er elektronegativer ist, die elektronische Dichte zu sich selbst an, was ein dauerhaftes Dipolmoment im Pyridin erzeugt. Daher interagieren Pyridinmoleküle durch Dipol-Dipolo-Kräfte.
Wasserstoffatome sind die ärmsten Regionen in Elektronen, so dass sie in Richtung des Stickstoffatoms eines benachbarten Moleküls ausgerichtet sind.
Kristallin
 Kristallstruktur von Pyridin. Quelle: orci/cc by-s (https: // createRecommons.Org/lizenzen/by-sa/3.0)
Kristallstruktur von Pyridin. Quelle: orci/cc by-s (https: // createRecommons.Org/lizenzen/by-sa/3.0) Pyridinmoleküle haben nicht nur Dipol-Dipolo-Kräfte, sondern auch mit Wechselwirkungen von aromatischen Ringen. Daher gelingt es diesen Molekülen, sich in geordneten Position zu positionieren, um einen ortorrombischen Strukturkristall (oberes Bild) bei einer Temperatur von -41,6 ° C zu verursachen.
Pyridineigenschaften
 Pyridinprobe. Lhchem/cc by-sa (https: // creativecommons.Org/lizenzen/by-sa/3.0)
Pyridinprobe. Lhchem/cc by-sa (https: // creativecommons.Org/lizenzen/by-sa/3.0) Aussehen
Farblose Flüssigkeit, mit einem durchdringenden Geruch, ähnlich wie der von Fischen.
Kann Ihnen dienen: Redox Balance -Methode: Schritte, Beispiele, ÜbungenMolmasse
79,1 g/mol
Dichte
0,9819 g/ml
Schmelzpunkt
-41,6 ºC
Siedepunkt
115,2 ºC
Löslichkeit
Es ist mit Wasser mischbar und auch mit Alkohol, Äther, Ölether, Ölen und vielen organischen Flüssigkeiten im Allgemeinen.
Dampfdruck
16 mmHg bei 20 ° C.
Wasserdampfdichte
2,72 in Bezug auf Wasser = 1
Brechungsindex (nD)
1.5093
Schmiere
0,88 cp
Dipolarem Moment
2.2 d
Zündungspunkt
21 ºC
Selbststeuerungstemperatur
482 ºC
Zersetzung
Wenn er erhitzt wird, emittiert ein Cyanidrauch.
Korrosion
Pyridin in flüssiger Form greift einige Formen von Kunststoffen, Gummi und Beschichtungen an.
pH
8,5 (0,2 m Lösung im Wasser)
Basizität und Reaktivität
Pyridin ist eine schwache Basis. Es ist ein tertiäres Amin, dessen 0,2 m -Lösung in Wasser einen pH -Wert von 8,5 erzeugt. Es hat eine geringe Affinität zu Elektronen aufgrund der Stickstoffelektronegativität, sodass ihre Kohlenstoffe normalerweise keine elektrophile Substitution erleiden.
Pyridin erfährt eine nukleophile Substitution, vorzugsweise in Positionen c4 und C2 Aus dem Ring. Aufgrund seiner Fähigkeit, Elektronen zu spenden.
Verwendung von Pyridin
Pestizide
Pyridin ist ein Herbizid -Vorläufer von Forequat- und Diquat -Herbiziden. Auf die gleiche Weise dient es für die Synthese des Chlorpirifos -Insektizids, dessen ursprünglicher Schritt die Chlorierung des Pyridins ist. Es ist auch der ursprüngliche Rohstoff, um das Fungizid basierend auf der Pyriition zu erhalten.
Lösungsmittel
Pyridin ist ein polares Lösungsmittel, das für Händlerreaktionen und Antibiotika -Extraktion verwendet wird. Pyridin wird als Lösungsmittel in der Lack- und Gummiindustrie sowie in Forschungslabors als Lösungsmittel bei der Extraktion von Pflanzenhormonen verwendet.
Medizin
Pyridin dient als Anfangspunkt in der Synthese von Cetilpyridinium und Laurilpyridinium, Verbindungen, die als Antiseptika in oralen und zahnärztlichen Pflegeprodukten verwendet werden. Das Pyridinmolekül ist Teil der chemischen Struktur zahlreicher Medikamente.
Zum Beispiel ESMEPRAZOL, der bei der Behandlung des gastroösophagealen Reflux verwendet wird. Loratidin ist ein weiteres Medikament, das auf Pyridin, das als Claritin bekannt ist, hergestellt wird, das als Behandlung allergischer Prozesse verwendet wird.
Pyridin (Phenazopyridin) Tabletten werden bei der symptomatischen Behandlung einer Reizung des Harnwegs verwendet, der in einigen Fällen Schmerzen, Verbrennung und Dringlichkeit des Urinierens begleitet wird. Phenazopyridin ist ein Farbstoff, der eine analgetische Funktion im Harnweg erfüllt.
Di-Acylhidrazin ist ein Pyridin-Derivat, das eine antibakterielle Aktivität aufweist, die auf Gram-negativen Bakterien ausübt, wie z UND. coli, und gram positive Bakterien wie z S. Albus.
Pyridin dient als Grundlage für Thiazolo [5,4-6] Pyridin, bestehend aus antiviraler Aktivität, insbesondere gegen das β-Mass-Virus von Influenza. Das 2-Acetylpyridin, ein Pyridinderivat, hat eine große Antitumoraktivität und ist ein Leukämie-Inhibitor.
Kann Ihnen dienen: Quecksilberoxid (HG2O)Andere
Pyridin wird zur Herstellung von Vitaminen, Gummiprodukten, Klebstoffen, Gemälden und Insektiziden verwendet. Es wird auch zur Denaturierung von Alkohol und bei der Färbung einiger Textilien verwendet.
20 % der Pyridin werden in der Piperidinvorbereitung verwendet. Piperidin interveniert in Vulkanisierung und Landwirtschaft.
Pyridin wird auch zur Synthese von polycarbonierten Harzen, als Lebensmittelgeschmack und als Reagenz zur Cyanid -Nachweis verwendet.
Toxizität
- Pyridin tritt in den Organismus ein, hauptsächlich aufgrund von Inhalation und Diffusion durch die Haut. Akute Exposition gegenüber Pyridin kann Reizungen und Verbrennungen in den Augen und Haut erzeugen.
- Pyridin kann Dermatitis und Allergie in der Haut entstehen. Die Entwicklung von Allergien kann zusätzlich zu Juckreiz und Ausschlag begleitet werden.
- Pyridininhalation kann Nasen- und Rachenreizungen verursachen, begleitet von Husten und einem asthmatischen Atemzugatum.
- Durch Einnahme kann Pyridin Übelkeit, Erbrechen, Durchfall und Bauchschmerzen verursachen. Ebenso kann die Einbeziehung einer hohen Dosis Pyridin in den Organismus verursachen: Kopfschmerzen, Müdigkeit, Verblassen, atemberaubende, Schwindel, Verwirrung und schließlich essen und tod.
- Die von der Wirkung des Pyridin am stärksten betroffenen Organe sind die Leber, die Nieren, die männlichen Genitalien und das Zentralnervensystem. Es kann auch auf Knochenmark wirken und die Produktion von Blutplättchen induzieren. Bei Tieren wurde eine krebserzeugende Wirkung von Pyridin nicht nachgewiesen.
Die OSHA hat eine Exposition in der Luft von 5 ppm pro 8 -stündiger Arbeitstag festgelegt.
Synthese
Die ersten Methoden zum Erhalten von Pyridin basierten auf der Extraktion von organischen Materialien. Thomas Anderson (1843) erhielt zum ersten Mal das Pyridin durch Erhitzen von Fleisch und Tierknochen. In einer ersten Stufe produzierte Anderson ein Öl, aus dem er die Pyridin destillieren konnte.
Traditionell wurde Pyridin aus der Hulla -Teer- oder Kohle -Vergasung erhalten. Diese Verfahren waren umständlich und von wenig Leistung, da die Pyridinkonzentration in diesen Rohstoffen sehr niedrig war. Eine Synthesemethode war notwendig.
Chichibabin -Methode
Obwohl es viele Methoden zur Pyridinsynthese gibt, wird das 1923 eingeführte Chichibabin -Verfahren hauptsächlich verwendet. Bei dieser Methode wird das Pyridin aus der Reaktion von Formaldehyd, Acetaldehyd und Ammoniak synthetisiert, die billige Reagenzien sind.
Kann Ihnen dienen: Art der Verbindung von 02In der ersten Stufe reagieren Formaldehyd und Acetaldehyd in einer Kondensationsreaktion von Knoevegel, die auch Wasser bildet, um auch Wasser zu bilden.
 Pyridinkondensation von Acetaldehyd
Pyridinkondensation von Acetaldehyd Schließlich reagiert Acroleína in einer zweiten Stufe mit Formaldehyd und Ammoniak, um Dihydropyridin zu bilden. Anschließend wird Dihydropyridin in einer Reaktion bei 350 bis 550 ° C in Gegenwart eines festen Katalysators zu Pyridin oxidiert.
Reaktionen
Elektrophylische Substitutionen
Diese Substitutionen treten normalerweise nicht aufgrund einer niedrigen elektronischen Pyridindichte auf.
Die Schwefelung hat größere Schwierigkeiten als die Nitrierung. Aber Bromation und Chlorierung treten leichter auf.
Pyridin-N-Oxid
Die Oxidationsstelle im Pyridin ist das Stickstoffatom, die Oxidation der Pfirsiche (Säuren mit einer OOH -Gruppe) erzeugt wird). Stickstoffoxidation fördert die elektrophile Substitution in Kohlenstoffen 2 und 4 von Pyridin.
Nukleophile Substitutionen
Pyridin kann aufgrund der geringen elektronischen Dichte der Pyridinring -Kohlenstoffe mehrere nukleophile Substitutionen erleben. Diese Substitutionen treten leichter im Pyridinmolekül auf, das durch Brom, Chlor, Fluor oder Sulfonsäure modifiziert wurde.
Die von nukleophilen Angriffen auf Pyridin durchgeführten Verbindungen sind normalerweise: Alcoxide, Tyolate, Amine und Ammoniak.
Radikale Reaktionen
Pyridin kann durch radikale Reaktionen verkleinert werden. Radikale Pyridin-Dimerisierung wird mit elementarem Natrium oder Nickel Raney durchgeführt, um 4,4'-Bipperidin oder 2,2'-Bipperidin herzustellen.
Reaktion auf Stickstoffatom
Laut Lewis können Säuren dem Stickstoffatom von Pyridin leicht zugesetzt werden und Pyridinsalze bilden. Pyridin ist eine Lewis -Basis, die ein paar Elektronen spendet.
Hydrierung und Reduktionsreaktion
Piperidin wird durch die Hydrierung von Pyridin mit Nickel, Kobalt oder Ruthenium erzeugt. Diese Reaktion wird bei hohen Temperaturen durchgeführt, die von der Verwendung eines Katalysators begleitet werden.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Pyridin. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2020). Pyridin. Pubchem -Datenbank., CID = 1049. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Laura Foist. (2020). Pyridin: Struktur, Formel und physikalische Eigenschaften. Lernen. Erholt von: Studium.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). Eine Überprüfung zur medizinischen Bedeutung von Pyridinderivaten. Journal of Drug Design and Medicinal Chemistry. Vol. 1, nein. 1, pp. 1-11. Doi: 10.11648/j.JDDMC.20150101.elf
- Webmd. (2020). Pyridin -Tablette. Abgerufen von: webmd.com
- New Jersey Department of Health und Senior Services. (2002). Pyridin. [PDF]. Erholt von: NJ.Regierung
- « C ++ - Geschichte, Eigenschaften, Datentypen, Beispiele
- Essentielle Fettsäuren Funktionen, Wichtigkeit, Nomenklatur, Beispiele »

