Pyruvatkinasestruktur, Funktion, Regulation, Hemmung
- 3841
- 490
- Jasmine Kupprion
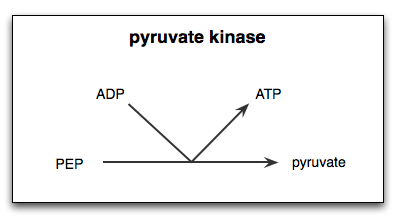
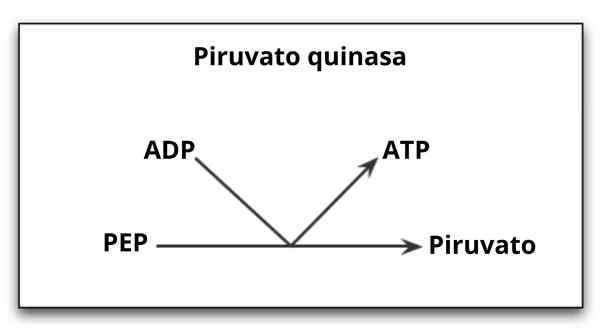 Reaktion durch die Enzympyruvato -Kinase katalysiert
Reaktion durch die Enzympyruvato -Kinase katalysiert Was ist das Kinase -Pyruvat?
Der Pyruvatkinase (Pyk) Es ist das Enzym, das den letzten Schritt des glykolytischen Weges katalysiert, was die irreversible Übertragung der Phosphatgruppe eines Phosphoenolpiruvat -Moleküls (PEP) in Richtung eines ADP -Moleküls impliziert Pyruvat.
Das später produzierte Pyruvat beteiligt sich an verschiedenen katabolen und anabolen (biosynthetischen) Routen: Es kann decarboxyliert werden, um Acetyl-CoA zu produzieren, carboxyliert Glucose.
Da es an der Glykolyse beteiligt ist, ist dieses Enzym für den Kohlenhydratstoffwechsel vieler Organismen, die eindeutig und mehrzellig sind, von größter Bedeutung, die dies als Hauptkatabolroute verwenden, um Energie zu erhalten.
Ein Beispiel für streng abhängige Glykolysezellen, um Energie zu erhalten.
Pyruvatkinasestruktur
Bei Säugetieren wurden vier Isoformen der Enzympyruvatkinase beschrieben:
- Pkm1, Typisch in Muskeln
- PKM2, Nur in Feten (beide Produkte der alternativen Verarbeitung derselben Messenger -RNA)
- PKL, in der Leber anwesend und
- PKR, in erythrozyten vorhanden (beide codiert von demselben Gen, PKLR, aber von verschiedenen Promotoren transkribiert).
Die Analyse zur Struktur der verschiedenen Enzymepyruvatkinase in der Natur (einschließlich dieser 4 der Säugetiere) zeigt jedoch eine große Ähnlichkeit in der allgemeinen Struktur sowie in Bezug auf die Architektur des aktiven Zentrums und der regulatorischen Mechanismen.
Kann Ihnen dienen: Kolonialverbände: Merkmale, Typen und BeispieleIm Allgemeinen handelt es sich um ein Enzym von 200 kDa -Molekulargewicht, das durch eine tetramere Struktur gekennzeichnet ist, die aus 4 identischen Proteineinheiten besteht, mehr oder weniger 50 oder 60 kDa und jeweils 4 Domänen, nämlich:
- Eine Domäne helikal klein am n-terminalen Ende (in bakteriellen Enzymen nicht vorhanden)
- Eine Domain "ZU”, Identifiziert durch eine Topologie von 8 gefalteten β -Scheiben und 8 Hallen α
- Eine Domain "B”, Eingefügt zwischen der gefalteten Beta -Lamina -Nummer 3 und der Alpha -Domäne„ A “-Domänendomäne
- Eine Domain "C”Mit einer α+β -Topologie
 Molekülstruktur der Enzympyruvatkinase
Molekülstruktur der Enzympyruvatkinase In den Tetrameren des Kinase -Pyruvats verschiedener Organismen wurden drei Stellen nachgewiesen: der aktiven Stelle, der Effektorstelle und der Aminosäurebindungsstelle. Das aktive Zentrum dieser Enzyme liegt zwischen den Domänen A und B, in der Nähe der „Effektorstelle“, die zur Domäne C gehört.
In der Tetrámero bilden D -Domänen eine "kleine" Schnittstelle, während Domänen eine größere Schnittstelle bilden.
Kinasepyruvatfunktion
Wie bereits erwähnt, katalysiert das Kinase -Pyruvat den letzten Schritt des glykolytischen Weges, dh die Übertragung einer Phosphatgruppe von Phosphoenolpiruvat (PEP) zu einem ADP.
Die von diesem Enzym katalysierten Produkte der Reaktion sind für verschiedene Stoffwechselkontexte von größter Bedeutung. Pyruvat kann auf unterschiedliche Weise verwendet werden:
- Unter aeroben Bedingungen kann dies in Gegenwart von Sauerstoff als Substrat eines Enzyms verwendet werden oder nehmen beispielsweise an anderen anabolen Routen wie Fettsäure -Biosynthese teil.
- In Abwesenheit von Sauerstoff oder Anaerobiose kann Pyruvat durch das Enzym -Lactat -Dehydrogenase zur Herstellung von Milchsäure (Oxidation) durch ein als "Laktikfermentation" bekanntes Prozess verwendet werden, der als "Laktikfermentation" bekannt ist.
- Darüber hinaus kann Pyruvat durch Gluconeogenese, durch Transaminase Alanin, in Oxalacetat durch Carboxylase -Pyruvat usw. durch Transaminase in Glucose umgewandelt werden.
Es ist wichtig zu beachten.
Aus dieser Perspektive spielt das Enzymkinase -Pyruvat in vielen Aspekten des Zellstoffwechsels eine grundlegende Rolle, was für viele Krankheitserreger des Menschen als therapeutisches Ziel verwendet wird.
Verordnung
Das Kinase -Pyruvat ist ein äußerst wichtiges Enzym aus Sicht des Zellstoffwechsels, da es diejenige ist, die die letzte Verbindung bildet.
Neben einem der drei am meisten regulierten Enzyme der gesamten glykolytischen Route (die anderen beiden Hexoquinase (HK) und Phosphofrocerachinase (PFK)) ist das Kinase -Pyruvat ein sehr wichtiges Enzym für die Kontrolle des Stoffwechselflusses und der Produktion von ATP durch ATP durch durch ATP durch Glykolyse.
Es wird durch Phosphoenolpiruvat, eines seiner Substrate (homotrope Regulation) sowie von anderen mono- und diposphorylierten Zuckern aktiviert, obwohl seine Regulation von der Art des Isoenzyms abhängt, der betrachtet wird, der betrachtet wird, der betrachtet wird.
Einige wissenschaftliche Texte legen nahe, dass die Regulierung dieses Enzyms auch von seiner „Multidominium“ -Scharchitektur abhängt, da seine Aktivierung von einigen Rotationen in den Domänen der Untereinheiten und Veränderungen in der Geometrie des aktiven Zentrums abhängt.
Für viele Organismen hängt die Árosterische Aktivierung des Kinase-Pyruvats von der Fructose 1,6-Biphosphat (F16BP) ab, dies gilt jedoch nicht für Gemüseenzyme. Andere Enzyme werden ebenfalls durch cyclisches AMP und Glucose 6-phosphat aktiviert.
Kann Ihnen dienen: Hände: Eigenschaften, Struktur, FunktionenDarüber hinaus wurde gezeigt, dass die Aktivität der meisten untersuchten Pyruvatkinasen stark vom Vorhandensein von monovalenten Ionen wie Kalium (K+) und zweienten Ionen wie Magnesium (Mg+2) und Mangan (Mn+2) abhängt.
Hemmung
Das Kinase -Pyruvat wird hauptsächlich durch physiologischen Effektor gehemmt, sodass diese Prozesse zwischen verschiedenen Arten und sogar zwischen Zellen- und Geweben desselben Organismus erheblich variieren.
Bei vielen Säugetieren haben Glucagon, Epinephrin und AMPC hemmende Wirkungen auf die Kinase -Pyruvat -Aktivität, Effekte, die durch Insulin entgegengewirkt werden können.
Darüber hinaus wurde nachgewiesen, dass einige Aminosäuren wie Phenylalanin Wirkungen wie Wettbewerbsinhibitoren für dieses Enzym im Gehirn haben können.

