Polarität (Chemie) Was ist, Definition, Beispiele
- 3827
- 433
- Rieke Scheer
Was ist chemische Polarität?
Der Chemische Polarität Es ist eine Eigenschaft, die durch das Vorhandensein einer ausgeprägten heterogenen Verteilung der elektronischen Dichten in einem Molekül gekennzeichnet ist. In seiner Struktur gibt es daher negativ belastete Regionen (δ-) und andere positiv geladen (Δ+), was ein Dipolmoment erzeugt.
Das Dipolmoment (µ) der Verbindung ist eine Form der Expression der Polarität eines Moleküls. Es wird normalerweise als Vektor dargestellt, dessen Ursprung in der Last (+) liegt, und sein Ende befindet sich in der Last (-), obwohl einige Chemikalien es in umgekehrt darstellen.
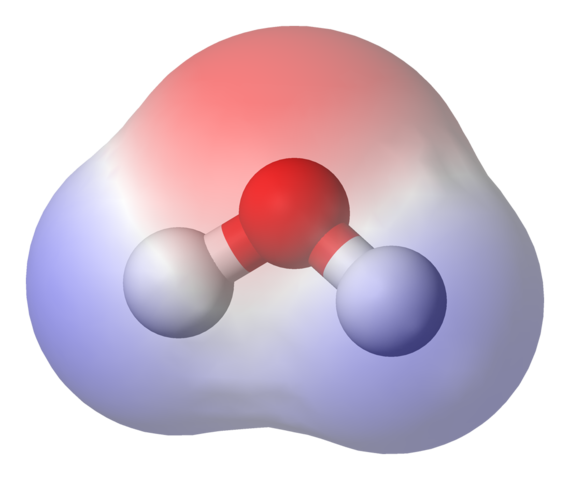
 Elektrostatische Potentialkarte für das Wassermolekül. Quelle: Benjah-BMM27 über Wikipedia.
Elektrostatische Potentialkarte für das Wassermolekül. Quelle: Benjah-BMM27 über Wikipedia. Im oberen Bild wird die elektrostatische Potentialkarte für Wasser gezeigt, h2ENTWEDER. Die rötliche Region (Sauerstoffatom) entspricht der mit der höchsten elektronischen Dichte, und es ist auch ersichtlich, dass es sich in den blauen Regionen (Wasserstoffatomen) abhebt.
Da die Verteilung der elektronischen Dichte heterogen ist, wird gesagt, dass es einen positiven und einen negativen Pol gibt. Deshalb sprechen wir über chemische Polarität und im Moment Dipol.
Dipolarem Moment
Das Dipolmoment µ wird durch die folgende Gleichung definiert:
µ = Δ ·D
Wobei δ elektrische Ladung für jeden Pol ist, positiv (+δ) oder negativ (-& dgr;) und D Es ist der Abstand zwischen ihnen.
Das Dipolmoment wird normalerweise in Debye ausgedrückt, dargestellt durch das Symbol D. Eine Coulomb · Metro entspricht 2.998 · 1029 D.
Der Wert des Dipolmoments der Verbindung zwischen zwei verschiedenen Atomen betrifft den Unterschied in den Elektronegativitäten der Atome, die die Verbindung bilden.
Damit ein Molekül polar ist, reicht es nicht aus, polare Verbindungen in seiner Struktur zu haben, aber auch eine asymmetrische Geometrie haben; Auf diese Weise verhindert die Dipolmomente daran.
Kann Ihnen dienen: Carbonoide: Elemente, Eigenschaften und VerwendungAsymmetrie im Wassermolekül
Das Wassermolekül hat zwei O-H-Bindungen. Die Geometrie des Moleküls ist eckig, dh mit der Form von "V"; Die Dipolmomente der Links stornieren sich also nicht gegenseitig, aber die Summe von ihnen tritt auf, indem sie auf das Sauerstoffatom hinweisen.
Die elektrostatische Potentialkarte für H2Oder reflektieren Sie dies.
Wenn das H-O-H-Winkelmolekül beobachtet wird, kann die folgende Frage auftreten: Ist es wirklich asymmetrisch? Wenn eine imaginäre Achse gezeichnet wird, die das Sauerstoffatom überschreitet, wird das Molekül in zwei gleiche Hälften unterteilt: H-o | o-h.
Aber es ist nicht so, wenn die imaginäre Achse horizontal ist. Wenn diese Achse jetzt das Molekül wieder in zwei Hälften unterteilt, hat das Sauerstoffatom einerseits und andererseits die beiden Wasserstoffatome.
Deshalb die scheinbare Symmetrie von H2Oder hört auf zu existieren, und daher wird ein asymmetrisches Molekül berücksichtigt.
Polare Moleküle
Polare Moleküle müssen eine Reihe von Eigenschaften erfüllen, wie z. B.:
-Die Verteilung der elektrischen Ladungen in der molekularen Struktur ist asymmetrisch.
-Sie sind normalerweise im Wasser löslich. Dies ist zwischen polaren Molekülen zurückzuführen, die durch Dipol-Dipolo-Kräfte interagieren können, wobei Wasser durch ein großes Dipolmoment gekennzeichnet ist.
Darüber hinaus ist seine Dielektrizitätskonstante sehr hoch (78,5), sodass Sie separate elektrische Lasten aufrechterhalten können, die die Löslichkeit erhöhen.
-Im Allgemeinen haben polare Moleküle hohe Siede- und Fusionspunkte.
Diese Kräfte sind aus der Dipolo-Dipolo-Wechselwirkung, den dispersiven Kräften von London und der Bildung von Wasserstoffbrücken bestehen.
Kann Ihnen dienen: Eisensulfat (FESO4): Was ist, Struktur, Eigenschaften, Synthese-Aufgrund ihrer elektrischen Ladung können polare Moleküle Strom treiben.
Beispiele
SW2
Schwefeldioxid (also2). Sauerstoff hat eine Elektronegativität von 3,44, während die Schwefelelektronegativität 2,58 beträgt. Daher ist Sauerstoff elektronegativer als Schwefel. Es gibt zwei Links s = o, die oder eine Last Δ- und die S a Last Δ+.
Da es sich um ein Winkelmolekül mit dem S im Scheitelpunkt handelt, sind die beiden Dipolmomente in die gleiche Richtung ausgerichtet; Und deshalb summieren sie sich und machen so Molekül2 polar sein.
CHCL3
Chloroform (HCCL3). Es gibt einen C-H-Link und drei C-Cl-Links.
Die Elektronegativität von C beträgt 2,55 und die Elektronegativität von H 2,2. Somit ist Kohlenstoff elektronegativer als Wasserstoff; Und daher wird das Dipolmoment von H (δ+) auf das C (δ-) ausgerichtet: Cδ--Hδ+.
Bei C-Cl-Links hat das C eine Elektronegativität von 2,55, während der CL eine Elektronegativität von 3,16 hat. Das Dipol- oder Dipolmoment ist in den drei C -Links vom C bis zum CL ausgerichtet δ+-Cl δ-.
Wenn es einen schlechten Elektronenbereich um das Wasserstoffatom und eine Region gibt, die reich an Elektronen aus den drei Chloratomen besteht, die CHCL,3 Es wird als polares Molekül betrachtet.
Hf
Wasserstofffluorid hat nur eine H-F-Bindung. Die Elektronegativität von H beträgt 2,22 und die Elektronegativität des F 3,98. Daher endet Fluorid mit der größten elektronischen Dichte, und die Verbindung zwischen beiden Atomen wird am besten beschrieben als: Hδ+-Fδ-.
Kann Ihnen dienen: Aluminiumhydroxid: Struktur, Eigenschaften, Verwendungen, RisikenNH3
Das Ammoniak (NH3) hat drei N-H-Links. Die Elektronegativität des N beträgt 3,06 und die Elektronegativität von H 2,22. In den drei Bindungen ist die elektronische Dichte auf Stickstoff ausgerichtet und ist durch das Vorhandensein eines Paares freier Elektronen noch größer.
Das NH -Molekül3 Es ist tetraedrisch, wobei das Atom von n den Scheitelpunkt besetzt. Die drei Dipolmomente, die den N-H-Links entsprechen, sind in die gleiche Richtung ausgerichtet. In ihnen befindet sich Δ- in n und Δ+ in H. So sind die Links: nδ--Hδ+.
Diese Dipolmomente, die Asymmetrie des Moleküls und das elektronenfreie Drehmoment des Stickstoffs machen das Ammoniak zu einem hochpolaren Molekül.
Makromoleküle mit Heteroátomos
Wenn die Moleküle sehr groß sind, ist es nicht mehr genau, sie als apolar oder polar an sich zu klassifizieren. Dies liegt daran.
Diese Arten von Verbindungen werden als Amphiphilos oder Amphipatik bekannt. Da der apolare Teil in Elektronen in Bezug auf den polaren Teil als schlecht angesehen werden kann, ist in der Struktur eine Polarität vorhanden, und Amphipryl -Verbindungen werden als polare Verbindungen angesehen.
Im Allgemeinen ist zu erwarten, dass ein Makromolekül mit Heteroatomen Dipolmomente und damit chemische Polarität hat.
Heteroátomos wird von denen verstanden, die sich von denen unterscheiden, die das Skelett der Struktur ausmachen. Zum Beispiel ist kohlensäurehaltiges Skelett biologisch das wichtigste von allen und das Atom, mit dem Kohlenstoff (zusätzlich zu Wasserstoff) mithilfe von Heteroátomo bezeichnet wird.
Verweise
- Polare und unpolare Verbindungen. St. Louis Community College. Wiederhergestellt von: Benutzer.Stlcc.Edu
- Wie man Polarität erklärt. Wissenschaftlich. Erholt von: Scienting.com

