Nuklearporeneigenschaften, Funktionen, Komponenten
- 1346
- 205
- Frederike Birkemeyer
Er Nuklearpore (Aus dem Griechischen, Poren = Schritt oder Transit) ist die "Tür" des Kerns, die den größten Teil des Transports zwischen Nucleoplasma und Zytoplasma ermöglicht. Die Kernpore verbindet sich den internen und externen Membranen des Kerns, um Kanäle zu bilden, die für den Transport von Proteinen und RNA dienen.
Das Wort poro spiegelt nicht die Komplexität der fraglichen Struktur wider. Aus diesem Grund ist es vorzuziehen, sich auf den Kernporenkomplex (CPN) anstelle von nuklearen Poren zu beziehen. Das CPN kann Veränderungen in seiner Struktur während des Transports oder des Zellzyklus erleben.
 Quelle: r. S. Shaw in englischer Wikipedia. [CC BY-SA 2.5 (https: // creativecommons.Org/lizenzen/by-sa/2.5)]]
Quelle: r. S. Shaw in englischer Wikipedia. [CC BY-SA 2.5 (https: // creativecommons.Org/lizenzen/by-sa/2.5)]] Vor kurzem wurde entdeckt, dass Nucleoporine, Proteine, aus denen die CPN besteht, eine wichtige Rolle bei der Regulierung der Genexpression spielen. Wenn also Mutationen auftreten, die die Funktion von Nucleoporinen beeinflussen, werden Pathologien beim Menschen wie Autoimmun, Kardiomyopathien, Virusinfektionen und Krebs erzeugt.
[TOC]
Eigenschaften
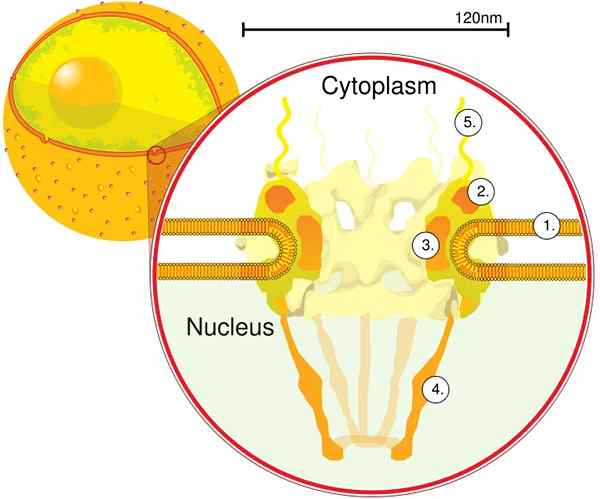
Durch die Elektronentomographie wurde festgestellt, dass die CPN eine Dicke von 50 nm, einen äußeren Durchmesser zwischen 80 und 120 nm und einen Innendurchmesser von 40 nm aufweist. Große Moleküle wie die große Untereinheit von Ribosomen (PM 1590 kDa) können außerhalb des Kerns durch den CPN exportiert werden. Es wird geschätzt, dass es zwischen 2000 und 4000 CPN pro Kern gibt.
Das Molekulargewicht eines einzelnen CPN liegt ungefähr zwischen 120 und 125 MDA (1 MDA = 106 Da) bei Wirbeltieren. Im Gegensatz dazu ist das CPN in Hefen kleiner, in denen es ungefähr 60 MDA hat. Trotz der enormen Größe des CPN sind Nucleoporine in allen Eukaryoten stark erhalten.
Die Translokalisierung durch den CPN ist ein schneller Prozess, dessen Geschwindigkeit 1000 Translokationen/Sekunden beträgt. Das CPN bestimmt jedoch nicht die Richtung des Transportflusses selbst.
Dies hängt vom RangTP -Gradienten ab, der im Kern größer ist als im Cytosol. Dieser Gradient wird von einem Guanine -Austauscherfaktor aufrechterhalten, der ausgeführt wurde.
Während des Zellzyklus erleben die CPNs Assemblierung und Uneinigkeitszyklen. Die Baugruppe erfolgt an der Grenzfläche und unmittelbar nach der Mitose.
Funktionen
Ribonukleinsäure (kleine Kern -RNA, Messenger -RNA, Transfer -RNA), Proteine und Ribonukleoproteine (RNP) müssen aktiv über CPN transportiert werden. Dies bedeutet, dass die Energie von ATP- und GTP -Hydrolyse erforderlich ist. Jedes Molekül wird auf eine bestimmte Weise transportiert.
Im Allgemeinen sind RNA. Im Gegensatz dazu müssen Proteine, die aktiv zum Kern transportiert werden, ein Sequenzzeichen einer Position im Kern (SLN), Besitzer von Aminosäureabfällen mit positiver Belastung (z. B. KKKRK), Besitzer von Aminosäureabfällen aufweisen müssen (z. B. KKKRK).
Kann Ihnen dienen: MesosomeProteine, die in den Kern exportiert werden.
Zusätzlich zur Erleichterung des Transports zwischen Kern und Zytoplasma sind CPNs an der Chromatinorganisation, der Genexpressionsregulation und der DNA -Reparatur beteiligt. Nucleoporine (NUPs) fördern die Transkriptionsaktivierung oder -repression unabhängig vom Zellproliferationszustand.
In Hefen befinden sich die Nupts im CNP der Kernverpackung. In den Metazoaries sind sie drinnen. Sie erfüllen die gleichen Funktionen in allen Eukaryoten.
Import von Substanzen
Durch das CPN wird die passive Verbreitung kleiner Moleküle in beide Richtungen und in den aktiven Transport, den Proteinimport, den Export von RNA und Ribonukleoproteinen (RNPs) und das bidirektionale Moleküle -Shuttle erfolgt. Letzteres umfasst RNA, RNP und Proteine, die an der Signalübertragung, Biogenese und Austausch beteiligt sind.
Der Import von Proteinen im Kern erfolgt in zwei Schritten: 1) Proteinbindung an die zytoplasmatische Seite des CPN; 2) ATP -abhängige Translokalisierung durch den CPN. Dieser Prozess erfordert eine ATP -Hydrolyse und den Austausch von GTP/BIP zwischen dem Kern und dem Zytoplasma.
Laut einem Transportmodell bewegt sich der Empfangsproteinkomplex entlang des Kanals durch die Vereinigung, die Dissoziation und die Vereinigung wieder zu den wiederholten FG-Sequenzen der Nucleoporine. Auf diese Weise bewegt sich der Komplex von einem Nucleoporin zum anderen innerhalb des CPN.
Substanzen Export
Ähnelt dem Import. Ran GTPase stellt den Transport durch CNP Richtungen auf. Ran ist ein molekularer Schalter mit zwei Konformationszuständen, je nachdem, ob er mit dem BIP oder GTP verbunden ist.
Zwei spezifische regulatorische Proteine lösen die Umwandlung zwischen den beiden Zuständen aus: 1) Cytosolische GTPase-Aktivierungsprotein (GAP), das GTP-Hydrolyse erzeugt und somit Ran-GTP in RAN-GTP umwandelt; und 2) Nuclear Guanina Austauschfaktor (GEF), der den Austausch des BIP durch GTP fördert und RAN-GTP in RAN-GTP umwandelt.
Cytosol enthält hauptsächlich Ran-BIP. Der Kern enthält hauptsächlich Ran-GTP. Dieser Gradient der beiden Konformationsformen von Ran lenkt den Transport in der entsprechenden Adresse.
Die Einfuhr des Empfängers zusammen mit der Position wird von der Union in die Wiederholungen-FG erleichtert. Wenn Sie die nukleare Seite des CNP erreichen, schließt sich Ran-GTP dem Empfänger an, um Ihre Position freizusetzen. Somit schafft Ran-GTP die Richtung des Importprozesses.
Der nukleare Export ist ähnlich. RAN-GTP im Kern fördert jedoch die Vereinigung der Position zum Exportempfänger. Wenn sich der Exportempfänger durch die Pore zum Cytosol bewegt, trifft er Ran-Gap, wodurch die GTP-Hydrolyse zum BIP induziert wird. Schließlich wird der Empfänger aus seiner Position entlassen und im Cytosol ran-BIP.
Kann Ihnen dienen: Polymorphonukleäre LeukozytenRNA -Transport
Der Export einiger Arten von RNA ähnelt dem Export von Proteinen. Zum Beispiel verwenden ARNT- und RNANS (Small Nuclear) den RangTP. Der Export von reifen Ribosomen hängt auch vom RangTP -Gradienten ab.
Die mRNA wird ganz anders als die Proteine und andere RNAs exportiert. Für ihren Export bildet die mRNA einen RNP Messenger (RNPM) -Komplex, in dem ein RNM -Molekül von Hunderten von Proteinmolekülen umgeben ist. Diese Proteine haben die Verarbeitung, Capping, Empalme und Polyadentilly von MNA.
Die Zelle muss in der Lage sein, zwischen RNPM mit reifen RNM und RNPM mit unreifen mRNA zu unterscheiden. Die mRNA, die den RPNM -Komplex bildet, könnte Topologien einnehmen, die für den Transport umgestaltet werden müssen. Bevor RNPM in den CPN eintritt.
Wenn reifen RNPM zusammengebaut werden, wird RPNM über einen Transportempfänger über den Kanal transportiert (NXF1-NXT1). Dieser Empfänger benötigt eine ATP -Hydrolyse (kein RangTP -Gradient), um die Richtungsumbau des RNPM zu ermitteln, das das Zytoplasma erreicht.
Der Kernporenkomplex und die Kontrolle der Genexpression
Einige Studien zeigen, dass CPN -Komponenten die Regulation der genetischen Expression durch die Kontrolle der Chromatinstruktur und deren Zugang zu Transkriptionsfaktoren beeinflussen könnten.
In Eukaryoten der neueren Evolution befindet sich Heterochromatin bevorzugt an der Peripherie des Kerns. Dieses Gebiet wird durch Euchromatin -Kanäle unterbrochen, die vom CPN -Kernkorb aufrechterhalten werden. Der Kernkorb -Assoziation mit Euchromatin ist mit der Gentranskription verwandt.
Beispielsweise impliziert die Aktivierung der Transkription auf CPN.
Somit ist der Kernkorb eine Plattform für zahlreiche Wartungsgene (Haushalt) stark transkribiert und Gene, die stark durch Veränderungen der Umgebungsbedingungen induziert werden.
Der Kernporen- und Virologiekomplex
Virale Eukaryot -Zellinfektion hängt von CPN ab. In jedem Fall einer Virusinfektion hängt ihr Erfolg von DNA, RNA oder RPN ab, die durch das CPN fließen, um ihr ultimatives Ziel zu erreichen, nämlich die Replikation des Virus.
Kann Ihnen dienen: Zytoplasmatische Einschlüsse: Was sind, Eigenschaften, FunktionenAPE Virus 40 (SV40) war eines der am häufigsten untersuchten Modelle, um die Funktion des CPN in der Translokalisierung innerhalb des Kerns zu untersuchen. Dies liegt daran, dass SV40 ein kleines Genom hat (5.000 Basen).
Es wurde gezeigt, dass der Transport der Virus -DNA Proteinproteine des Virus erleichtert wird, die das Virus schützen, bis der Kern erreicht.
Komponenten
Das CPN ist in den nuklearen Umschlag eingebettet und besteht aus ca. 500 und 1000 NUPTS. Diese Proteine sind in strukturellen Unterkomplexen oder Modulen organisiert, die miteinander interagieren.
Das erste Modul ist eine zentrale Komponente oder einen Ring in der Pore in Form einer Sanduhr, die auf beiden Seiten um einen weiteren Ring mit 120 nm Durchmesser begrenzt ist, intranukleär und cytoplasmatisch. Das zweite Modul sind die Kern- und Zytoplasma-.
Das dritte Modul sind acht Filamente, die aus dem 120 -nm -Ring innerhalb des Nucleoplasma projiziert werden und eine Korbstruktur bilden. Das vierte Modul besteht aus den Filamenten, die an der Seite des Zytoplasmas projiziert werden.
Der y -veränderte Komplex, der aus sechs NUPs und SEH 1 und Sec 13 -Proteinen besteht, ist der größte und am besten charakterisierte Komplex des CNP. Dieser Komplex ist die wesentliche Einheit, die Teil des CPN -Gerüsts ist.
Trotz der geringen Ähnlichkeit zwischen den NUPS -Sequenzen ist das CPN -Gerüst in allen Eukaryoten stark erhalten.
Verweise
- Beck, m., Verletzt, e. 2016. Der nukleare Porenkomplex: Verständnis seiner Funktion durch strukturelle Einsicht. Nature Reviews, Molekularbiologie, doi: 10.1038/nrm.2016.147.
- Ibarra, a., Hetzer, m.W. 2015. Nuklearporenproteine und die Kontrolle der Genomfunktionen. Gene und Entwicklung, 29, 337-349.
- Kabachinski, g., Schwartz, t.ODER. 2015. Der Kernporenkomplex - Struktur und Funktion auf einen Blick. Journal of Cell Science, 128, 423-429.
- Knocknhauer, k.UND., Schwartz, t.ODER. 2016. Der Kernporenkomplex als flexibles und dynamisches Tor. Zelle, 164, 1162-1171.
- Ptak, c., Aitchison, J.D., Wozniak, r.W. 2014. Das multifunktionale Kern nach Komplex: eine Plattform zur Kontrolle der Genexpression. Aktuelle Meinung der Zellbiologie, doi: 10.1016/j.CEB.2014.02.001.
- Staicki, s.P., Steffen, j. 2017. Republikation: Der Kernporenkomplex - eine umfassende Überprüfung von Struktur und Funktion. Internationales Journal of Academic Medicine, 3, 51-59.
- Tran, e.J., Gent, s.R. 2006. Dynamisches Kern von Komplexen: Leben am Rande. Zelle, 125, 1041-1053.

