Potentiometrie -Grundlagen, Gleichungen, Elektroden
- 4024
- 1007
- Nick Laurén
Der Potentiometrie Es handelt sich um eine elektrochemische Analysetechnik, die auf der Messung der Spannung eines Mediums oder eines Kompartiments basiert, mit dem die Aktivität oder Konzentration einer Spezies (ionisch oder molekular) bestimmt wird. Es ist eine nicht zerstörerische Technik, da sie nicht versucht, die chemische Natur des betreffenden Analyten zu ändern.
Um diese Analyse durchzuführen, sind mindestens zwei Elektroden unverzichtbar: einer der Referenz und eines weiteren Indikators oder einer anderen Arbeit. Ebenso muss es einen Voltmeter mit hoher Impedanz geben, mit dem die Spannungen gemessen werden.
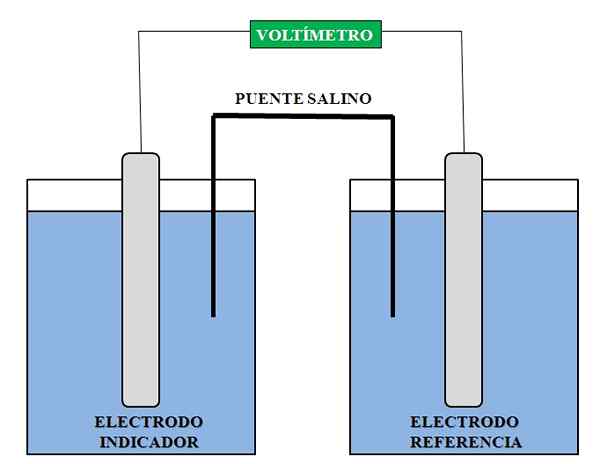
 Allgemeine Darstellung der notwendigen Elemente für eine potentiometrische Analyse. Quelle: Gabriel Bolívar.
Allgemeine Darstellung der notwendigen Elemente für eine potentiometrische Analyse. Quelle: Gabriel Bolívar. Oben haben wir eine allgemeine Darstellung der Baugruppe für eine potentiometrische Analyse. In dem Kompartiment, in dem die Indikatorelektrode eingeführt wird, ist die Spezies, deren Konzentration wir bestimmen möchten; Während wir in der Referenzelektrode haben eine andere Lösung, in der wir die Konzentrationen ihrer Komponenten kennen.
Die registrierte Spannungslesung ist im Prinzip auf die interessierenden Arten fällig, die sich der Indikatorelektrode nähert. Mit dieser Spannung berechnen wir die Konzentration dieser Spezies beispielsweise die von CA -Ionen2+, Ag+, H+, N / A+, K+, Cl-, usw. Potentiometrie verwendet daher in der klinischen, umweltbedingten, analytischen und physikochemischen Chemie.
[TOC]
Grundlagen
Die Spannung, die in den potentiometrischen Analysen bestimmt wirdZelle, Dies ist die Differenz zwischen den durch die beiden Elektroden verursachten Spannungen, dem Indikator und der Referenz. Die Elektroden reagieren empfindlich gegenüber den Aktivitäten der Moleküle oder Ionen, die sie umgeben, in der Lage sind, Elektronen von ihnen zu akzeptieren oder im Gegenteil zu ergeben.
Die beiden Kompartimente sind angeschlossen, so.
Diese Übertragung von Elektronen (oder Strom) ist jedoch nahezu nil, da sich die Redoxreaktionen ansonsten entwickeln würden, um die Konzentrationen und Identitäten der beteiligten Spezies vollständig zu verändern.
Kann Ihnen dienen: Wasserstoffbromid (HBR)Stattdessen erlaubt der Voltmeter kaum den Durchgang von Elektronen, so dass es einen stabilen Spannungswert gibt und dass die Zelle das thermodynamische Gleichgewicht erreichen kann.
Es wird daher gesagt, dass die Potentiometrie eine nicht zerstörerische Technik ist, da nur wenige Ionen oder Moleküle in den Messprozess umgewandelt werden, der ebenfalls reversibel ist.
Hauptgleichungen
Zellpotential
Das Potenzial der Zelle hängt mit den Aktivitäten oder Konzentrationen der interessierenden Arten durch die Nernst -Gleichung zusammen:
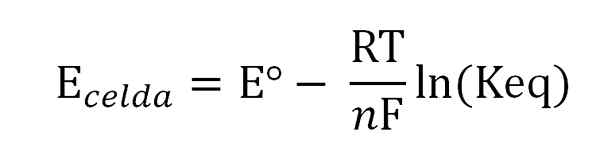 Nernst -Gleichung. Quelle: Gabriel Bolívar.
Nernst -Gleichung. Quelle: Gabriel Bolívar. Wobei eº das Potenzial derselben Zelle unter Standardbedingungen ist, f die Faraday -Konstante, N Die Anzahl der übertragenen Elektronen, r die Gaskonstante und keq die Gleichgewichtskonstante der globalen Reaktion. Die Berechnungen werden durchgeführt, indem Keq vor der Lesung von e gelöscht wirdZelle, und Berechnung der gewünschten Konzentration Ihres Gleichgewichtsausdrucks.
Es ist jedoch zweckmäßig, die Konzentrationen um einen leichteren Weg zu berechnen. Durch Konvention wird das Potenzial der Zelle auch durch die folgende Gleichung gegeben:
UNDZelle = ENetz- UNDOchse
Wo eNetz Es ist das Potenzial für die Reduktionssemi -Media, wobei sich die Indikatorelektrode befindet. während eOchse Es ist das Potenzial für Oxidations -Semi -Media, wo wir die Referenzelektrode haben. Somit kann die Gleichung als:
UNDZelle = EIndikator - UNDReferenz + UNDJ
EJ entspricht dem Potential, das durch die Gelenkbrückenverbindungen verursacht wird. In der Praxis undJ Es kann nicht bestimmt werden, aber stellen Sie sicher, dass sein Wert mit sehr verdünnten Lösungen so minimal wie möglich ist oder sicherstellt, dass die Zusammensetzungen in beiden Kompartimenten ähnlich sind.
Potenzial des Analyten
Aus der vorherigen Gleichung können wir berechnen undIndikator, Welches ist das Potenzial, das uns wirklich interessiert. Mit diesem Wert wenden wir die Nernst -Gleichung erneut an:
Kann Ihnen dienen: Acetonitril (C2H3n)UNDIndikator = Eº - (rt/nf) ln (rot/ox)
Netzwerk ist die reduzierte Form des Analyten oder der interessierenden Spezies, und Ox ist seine oxidierte Form. Angenommen, der Analyte ist die Kationen Zn2+ Auf einer metallischen Zinkelektrode hätten wir:
UNDIndikator = EºZn2+/Zn - (RT/NF) ln (1/ZuZn2+)
Wo ZuZn2+ Es ist die Zn -Kation -Aktivität2+, die durch experimentelle Anpassungen ziemlich nahe an seiner Konzentration liegt, [Zn2+]. Aus dieser Gleichung wird die Zn -Konzentration gelöscht2+, Dies beeinflusst direkt den Wert von eIndikator.
Die reduzierte Form von Zink, Zn, präsentiert eine Aktivität gleich 1. Daher ist die allgemeine Gleichung für rostige Kationen eines Metalls, das als Elektrode wirkt, gleich:
UNDIndikator = EºMn+/m - (RT/NF) ln (1/ZuM+N)
Dies gilt jedoch nur bei den ersten Spezieselektroden.
Elektroden
Elektroden sind zusätzlich zu Voltmeter die wichtigsten Elemente einer potentiometrischen Analyse. Einige von ihnen werden unten erwähnt.
Erste Art
Die ersten Spezieselektroden sind Metalle, die oxidieren, um Kationen zu verursachen, und Elektronen zum Voltmeter durchführen. Einige davon sind die folgenden: Ag, Zn, Cu, Hg, Sn, Tl, Cd und Bi.
Nicht alle Metalle dienen als Erstklassenelektroden, da sie keine kristallinen Unregelmäßigkeiten oder Oberflächen aufweisen sollten, die von Oxidschichten bedeckt sind, die instabile Spannungen verursachen.
Zweite Art
Zweite Spezieselektroden hingegen sind ebenfalls metallisch, enthalten aber auch ein Salz auf ihrer Oberfläche, dessen Löslichkeit von den auftretenden Redoxreaktionen abhängt, die stattfinden. Zum Beispiel Ag-AgCl- und HG-HG-Elektroden2Cl2 (Kalomel) sind zweite Spezieselektroden.
Selektive Ionen
Die selektiven Ionenelektroden, auch als Membranen bezeichnete, sind diejenigen, die für ein bestimmtes Ion oder Molekül empfindlich sind, das durch eine Membran schleicht.
Kann Ihnen dienen: Begrenzung und übermäßiges ReagenzDas beliebteste Beispiel dieser Art von Elektrode ist das von Glas, die zur Bestimmung der Konzentration von H -Ionen gebaut wurde3ENTWEDER+ oder h+, Und somit als Pehometer dienen.
Potentiometrieanwendungen
Umweltchemie
Potentiometrie wurde in der Umweltchemie bei der Bestimmung von CN -Ionen verwendet-, F- und nicht3-, sowie Ammoniak in Wasserströmungen.
Klinische Chemie
Selektive Elektroden sind sehr nützlich, wenn das Messmedium komplex ist. Daher stören die anderen Ionen oder Moleküle die Messwerte.
Dieses Merkmal ist besonders vorteilhaft in den potentiometrischen Bestimmungen, die in denselben Zellen durchgeführt werden, in denen Mikroelektroden injiziert werden, um die KK -Konzentrationen zu bestimmen+, N / A+, Cl-, AC2+ oder h+.
Potentiometrische Grade
Angenommen, in der Mitte, wo wir die Indikatorelektrode haben, wird ein Titel hinzugefügt, der mit dem Analyten reagiert und daher seine Konzentration modifiziert. Dann treten Änderungen im E aufZelle, Dies entspricht in gleicher Weise der Änderung des pH-Werts in einer Säure-Base-Titration.
So grafisch undZelle vs. VTitulant, Wir können den Wendepunkt oder die Äquivalenz bestimmen, und damit werden wir die Konzentration des Analyten kennen.
Potentiometrische Abschlüsse werden häufig in analytischen und physikalisch -chemischen Chemielabors eingesetzt. Einige der Analyten, die mit dieser Technik bestimmt werden können2+, HCO3-, AC2+, Mg2+, Cu2+, Ascorbinsäure, Haluros unter anderem.
Alle Grad können in gewissem Maße über potentiometrisch anstatt auf die Indikatoren und ihre endgültigen Punkte zurückzugreifen.
Verweise
- Tag, r., & Underwood, a. (1986). Quantitative analytische Chemie (Fünfter Aufl.). Pearson Prentice Hall.
- Skoog d.ZU., West d.M. (1986). Instrumentalanalyse. (Zweite Ed.). Inter -American., Mexiko.
- DR. Doug Stewart. (2020). Definition der Potentiometrie. Erholt von: Chemicoolool.com
- Harvey David. (5. Juni 2019). Potntiometrische Methoden. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Britannica Encyclopaedia. (2020). Elektrogravimetrie. Erholt von: Britannica.com
- Wikipedia. (2020). Elektroanalytische Methoden. Abgerufen von: in.Wikipedia.Org
- « Kalomel -Elektrodenbetrieb, Eigenschaften, verwendet
- Stimulierung von Arzneimitteltypen und deren Eigenschaften »

