Aufbau -Prinzip

- 3954
- 1208
- Joy Hort
 Atom -Orbitale -Füllordnung nach dem Aufbau -Prinzip
Atom -Orbitale -Füllordnung nach dem Aufbau -Prinzip Was ist das Aufbau -Prinzip?
Er Aufbau -Prinzip, Es ist auch eine praktische Regel, die die Vorhersage der elektronischen Konfiguration der überwiegenden Mehrheit der Elemente der Periodenzüchter sowie der der Ionen ermöglicht.
Dieses Prinzip legt fest, dass die Elektronen, die nach dem anderen nacheinander Protonen zum Kern hinzugefügt werden, nacheinander, um jedes chemische Element zu bauen.
Mit anderen Worten, Aufbau stellte fest, dass es eine bestimmte Reihenfolge gibt, nach der atomare Orbitale gefüllt werden können. Diese Bestellung wird unten erläutert.
Die Reihenfolge der Füllung der Orbitale nach dem Prinzip von Aufbau
Die Reihenfolge, in der atomare Orbitale gefüllt werden, hängt von ihrem Energieniveau ab. Die goldene Regel ist, dass diese Energieniveaus am wenigsten bis zum größten gefüllt sind, als wäre es ein Gebäude, in dem die Wohnungen in den niedrigsten Stockwerken gefüllt werden sollten, um auf die höchsten Stockwerke zuzugreifen.
In diesem Sinne müssen wir zunächst wissen, wie sie nach ihrem Energieniveau bestellt werden, um die Reihenfolge der Füllung der Orbitale vorherzusagen. In der Analogie des Gebäudes bedeutet dies, zu wissen, welche (Orbital-) Apartments auf jedem Boden sind.
Die folgende Grafik zeigt die Energieniveaus der ersten atomaren Orbitale, die von niedrigsten bis größeren Energie geordnet sind.
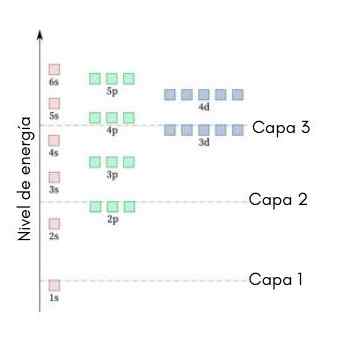
In diesem Bild repräsentiert jedes Bild ein bestimmtes Orbital, in das nur 2 Elektronen passen. Jede Gruppe von Gemälden derselben Farbe repräsentiert einen unteren Energieebene.
Diese Sub -Levels werden durch eine Zahl und einen Buchstaben (1s, 3p, 3D usw. identifiziert.). Die Zahl gibt das Hauptergieniveau an, während der Buchstaben die Art des Orbitals angibt, der die Gruppe bildet.
Es kann Ihnen dienen: Aluminiumchlorid (Alcl3)Nach diesem Schema ist der erste untergefüllte Unter -Level, der gefüllt werden muss.
Die Regenregel
Obwohl es einfach ist, die Reihenfolge der Füllung festzulegen, wenn Sie eine Grafik wie die vorherige haben, ist es schwierig, sich an die bestimmte Reihenfolge zu erinnern, in die die verschiedenen Sub -Levels gehen. Dafür wird das, was manche "die Regel des Regens" bezeichnen, verwendet.
Diese Regel besteht aus zwei einfachen Schritten:
Schritt 1
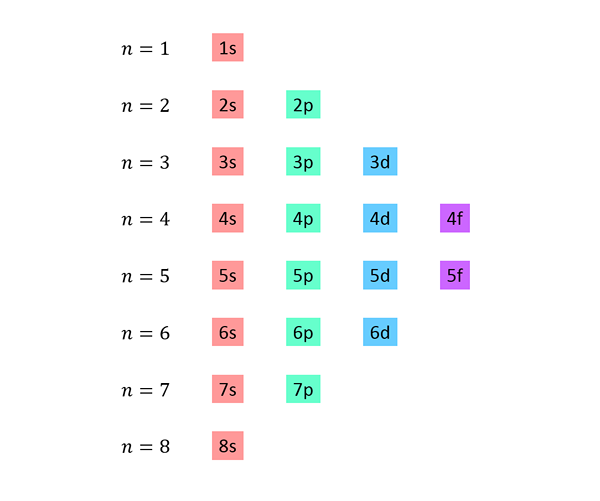
Es wird eine Liste erstellt, in der jede Linie einem Energieniveau entspricht und eins nacheinander enthält, alle unter diesem Niveau verfügbaren Unter -Levels.
Beispielsweise entspricht die erste Zeile Level 1 (n = 1) und enthält nur die 1S -Sub -Level; Die zweite Zeile entspricht Level N = 2 und enthält 2S- und 2p -Sub -Levels; Der dritte enthält die 3S-, 3P- und 3D -Sub -Levels usw.
Die vollständige Liste sieht folgendermaßen aus:
Schritt 2
Abstiegsdiagonale werden von rechts nach links gezeichnet, einer untereinander, wie unten gezeigt.
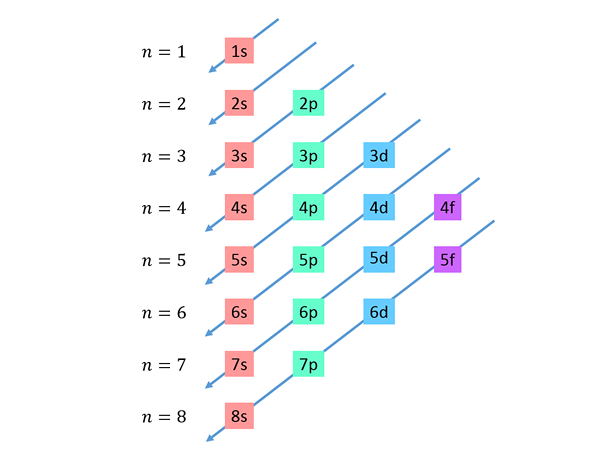
Diese Linien ähneln dem Weg der Wassertropfen während eines Windes mit Wind, so dass diese Grafik normalerweise als "Regenmethode" bezeichnet wird. Die Ausfüllreihenfolge wird durch die Reihenfolge bestimmt, in der diese Diagonalen die Sub -Levels in der Liste berühren.
Basierend auf der vorherigen Abbildung ist die Reihenfolge der Energie der Orbitale und daher die Reihenfolge, in der sie gefüllt werden müssen,:
Kann Ihnen dienen: Quantentisch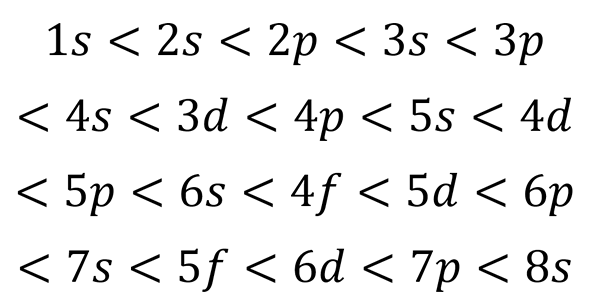
Diese Ausfüllreihenfolge ist die einzige, die beim Schreiben der elektronischen Konfiguration eines Atoms wirklich wichtig ist. Beim Füllen dieser Sub -Levels muss erinnert werden, dass in den Sub -Levels S Nur 2 Elektronen passen hinein P passen 6, in die D Sie passen 10 und in die F Sie passen 14.
Ausnahmen zu Beginn von Aufbau
Das Aufbau -Prinzip legt eindeutig fest, dass ein Sub -Level erst gefüllt werden kann, wenn alle vorherigen Sub -Levels vollständig gefüllt sind. Es gibt jedoch einige Ausnahmen von dieser Regel.
In einigen Fällen bevorzugt das Atom es vor, einen sub -sub -energiespezifischen Niveau in zwei Hälften gefüllt zu haben, als eine unvollständige, die nicht in zwei Hälften voll ist. In diesen Fällen stimmt die tatsächliche elektronische Konfiguration des Atoms nicht mit der vorhergesagten Reihenfolge mit der Regenmethode überein.
Zum Beispiel sollte das Chromatom nach dem Aufbau -Prinzip eine elektronische Konfiguration haben, die in 4S endet2 3d4. Die reale Konfiguration beträgt jedoch 4s1 3d5 Da sind die 4S- und 3D -Sub -Levels in der anderen Konfiguration Nr.
Gleiches gilt für Kupfer, deren Konfiguration in 4s endet1 3d10, statt 4s2 3d9, Da füllt sub -Level d und s in zwei Hälften voll.
Beispiele für die Anwendung des Aufbau -Prinzips
Als nächstes gibt es 5 Beispiele für Elemente, die dem Aufbau -Prinzip entsprechen:
Beispiel 1: Natriumelektronische Konfiguration
Natrium ist Element 11, also hat es 11 Protonen und 11 Elektronen. Die elektronische Konfiguration beträgt 1s2 2s2 2 p6 3s1.
Beispiel 2: Elektronische Argon -Konfiguration
Argon (AR) ist Element 18, also hat es 18 Protonen und 18 Elektronen. Die elektronische Konfiguration ist daher 1s2 2s2 2 p6 3s23p6. Es ist zu sehen, dass seine Sub -Levels und P -Sub -Levels vollständig waren.
Kann Ihnen dienen: Propylen (C3H6)Beispiel 3: Elektronische Galliumkonfiguration
Gallium (GA) ist Element 31, also hat es 31 Protonen und 31 Elektronen. Die elektronische Konfiguration beträgt 1s2 2s2 2 p6 3s23p64s23d104p1.
Dies kann zusammenfassend als [ar] 4s geschrieben werden23d104p1, wobei [AR] die im vorherige Beispiel dargestellte elektronische Argonkonfiguration darstellt.
Beispiel 4: Elektronische Kohlenstoffkonfiguration
Kohlenstoff (c) ist Element 6, also hat es 6 Protonen und 6 Elektronen. Die elektronische Konfiguration beträgt 1s2 2s2 2 p2.
Beispiel 5: Elektronische Chlorkonfiguration
Chlor (Cl) ist Element 17. Seine 17 Elektronen sind gemäß den folgenden elektronischen Konfigurationen verteilt: 1s2 2s2 2 p6 3s23p5 oder [ne] 3s23p5.
Zusätzliche Beispiele für Ausnahmen zu Beginn von Aufbau
Als nächstes gibt es 2 zusätzliche Beispiele für Elemente, die gegen den Aufbau -Prinzip verstoßen:
Beispiel 6: elektronische Molybdänkonfiguration
Molybdän (MO) ist Element 42. Die ersten 36 Elektronen sind genauso verteilt wie im Krypton, aber seine Valenzelektronen folgen nicht der normalen Reihenfolge. Anstatt elektronische Konfiguration [KR] 5s zu haben24d4, Seine Konfiguration beträgt [KR] 5s14d5, Ähnlich wie bei Chrome, was passiert.
Beispiel 7: Silber -Elektronikkonfiguration
La Plata (AG, Element 47) stellt einen Verstoß gegen das Aufbau -Prinzip vor, ähnlich dem von Kupfer. Seine elektronische Konfiguration beträgt [KR] 5s14d10 Anstelle von [kr] 5s24d9.

