Le châtelier Prinzip

- 3017
- 876
- Lewis Holzner
Was ist Le Châteliers Prinzip??
Er Le châtelier Prinzip Es ist eine allgemeine Regel, die den Effekt vorhersagt, dass die verschiedenen Faktoren, die das chemische Gleichgewicht beeinflussen. Insbesondere hilft es vorherzusagen, in welche Richtung eine Reaktion, die sich im Gleichgewicht befindet.
Dieses Prinzip legt das fest:
"Wenn ein System, das im Gleichgewicht ist, einer Störung oder einer externen Spannung ausgesetzt ist, reagiert das System in die Richtung, die es ihm ermöglicht, einer solchen Störung teilweise entgegenzuwirken.".
Störung ist gut verstanden:
- Eine Veränderung der Konzentration eines der Reagenzien.
- Eine Änderung der Konzentration eines der Produkte.
- Druckänderungen.
- Volumenänderungen.
- Eine Temperaturänderung
Wenn Änderungen wie erwähnt auftreten, wird eine der beiden Reaktionen, die direkte oder das Inverse, in Bezug auf das andere bevorzugt, so dass das System in diesem Sinne zu einem neuen Gleichgewichtszustand reagiert.
Dies ähnelt den Anpassungen eines Balancers auf der Drehung. Wenn die Schwerkraft auf einer Seite Hala. Wir sagen, dass sich sein Gleichgewicht bewegt hat, da er immer noch im Gleichgewicht ist (er fällt nicht), aber jetzt hat er eine andere Position.
Als Nächst.
Auswirkung von Konzentrationsänderungen
Angenommen, wir haben die folgende Reaktion im Gleichgewicht:
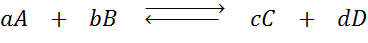
Wenn wir die Konzentration einer der beteiligten Arten (A, B, C oder D) ändern. 4 verschiedene Situationen können gegeben werden:
1. Erhöhte Konzentration von Reagenzien
Wenn wir die Konzentration eines Reagenzs erhöhen, um zum Beispiel nach dem Prinzip von Le Châtelier, reagiert das System, um den zusätzlichen Überschuss zu konsumieren. Dies bedeutet, dass es direkt (von links nach rechts) reagiert, da diese Richtung in diese Richtung verzehrt wird.
In diesem Fall wird gesagt, dass die direkte Reaktion bevorzugt wird und dass sich das Gleichgewicht gegenüber den Produkten bewegte, da im neuen Gleichgewicht die Konzentration von Produkten größer ist als die im ursprünglichen Gleichgewicht.
Kann Ihnen dienen: Magnetische Trennung2. Erhöhte Konzentration von Produkten
Wenn wir die Konzentration eines Produkts, beispielsweise C, erhöhen, reagiert das System umgekehrt, um den zugegebenen überschüssigen C zu konsumieren (dh von rechts nach links).
In diesem Fall wird gesagt, dass die umgekehrte Reaktion bevorzugt wird und dass sich das Gleichgewicht zu den Reagenzien bewegt.
3. Abnahme der Reagenzkonzentration
Die Konzentrationsabnahme hat den gegenteiligen Effekt auf den Anstieg der Konzentration. Wenn wir uns aus dem Medium zurückziehen und somit seine Konzentration verringern, reagiert das System nach links (in der Rückseite), um der Änderung entgegenzuwirken. Das Gleichgewicht bewegt sich in Richtung der Reagenzien.
4. Abnahme der Produktkonzentration
Wenn wir die Konzentration von C oder D verringern, reagiert das System direkt, um die verminderte Konzentration (dh von links nach rechts) zu ersetzen). Das Gleichgewicht bewegt sich in Richtung der Produkte.
Beispiel:
Bestimmen Sie den Effekt der Zugabe von mehr Tiozianaten (SCN-) Im folgenden chemischen Gleichgewicht ist es gelb, das Produkt des Rechts intensiv zu rot und Eisen (III) ist gelb.
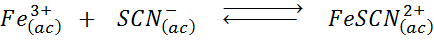
Lösung: In diesem Fall fügen wir Tiocianato hinzu, das ein Reagenz ist, so.
Auswirkung von Volumen- und Druckänderungen
Änderungen von Volumen und Druck beeinflussen die Reaktionen im Gleichgewicht im flüssigen oder festen Zustand nicht wesentlich, sondern können diejenigen beeinflussen, die in einem gasförmigen Zustand gefunden werden. Dies liegt daran, dass die Konzentration für Gase proportional zum Druck ist, wie durch das ideale Gasesgesetz vorhergesagt.
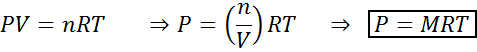
Das Erhöhen des Drucks eines Gas, der die konstante Temperatur aufrechterhalten.
Wenn ein Gesamtdruck auf eine Gleichgewichtsreaktion in Gleichgewicht steigt (oder wir sein Volumen verringern), reagiert das System erneut, um diesen Druck erneut zu verringern.
Kann Ihnen dienen: feine Schichtchromatographie: Eigenschaften, wofür es ist In der Reaktion zwischen Stickstoff und Wasserstoff zur Bildung von Ammoniak werden 4 Soda -Moleküle verbraucht und nur zwei produziert, so
In der Reaktion zwischen Stickstoff und Wasserstoff zur Bildung von Ammoniak werden 4 Soda -Moleküle verbraucht und nur zwei produziert, so Wenn in der Reaktion, die sie verbraucht werden und die gleiche Anzahl von Gasmolekülen erzeugt wird, wirkt sich das Gleichgewicht nicht aus.
Wenn wir dagegen nur den Teildruck einer der Gase modifizieren, ist der Effekt der gleiche, der die Konzentration dieser Spezies erhöht oder verringert.
Beispiel:
Angesichts der Zersetzungsreaktion von Dyitrogen -Tetroxid im Gleichgewicht:
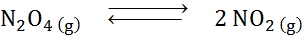
Bestimmen Sie den Effekt der Reduzierung des Volumens und des zunehmenden Drucks.
Lösung: Wenn wir den Gesamtsystemdruck erhöhen oder sein Volumen verringern, bewegt sich das Gleichgewicht in Richtung der Reagenzien, da in dieser Richtung eine Nettoabnahme der Gasmoleküle (2 und 1) verbraucht wird 1), wodurch der Druckerhöhung entgegenwirkt.
Auswirkung von Temperaturänderungen
Der Effekt der Temperatur auf das chemische Gleichgewicht unterscheidet sich von den anderen bisher gesehenen Faktoren, die wir bisher gesehen haben. In den vorherigen Fällen wird nach der Störung ein neues Gleichgewicht erhalten, aber die gleiche Gleichgewichtskonstante wird beibehalten. Wenn sich jedoch die Temperatur ändert, ändert sich die Gleichgewichtskonstante.
Um zu wissen, wie sich die Gleichgewichtskonstante mit der Temperatur ändert, muss das Vorzeichen der Reaktionsenthalpie bekannt sein:
- Wenn eine Reaktion Wärme freigibt, dh sie ist exotherm, ihre Enthalpie negativ und die Gleichgewichtskonstante nimmt mit zunehmendem Temperatur ab. In diesen Fällen bewegt sich das Gleichgewicht in die entgegengesetzte Richtung zu den Reagenzien.
- Wenn eine Reaktion Wärme absorbiert, das heißt, ist sie endotherm, ihre Enthalpie ist positiv und das Gegenteil geschieht.
Das Erinnern an die Auswirkung der Temperatur ist einfach, wenn wir Wärme als ein Reagenz betrachten, das bei exothermen Reaktionen auftritt und im Fall von Endothermen konsumiert wird. Die Erhöhung der Temperatur wäre wie "Wärme hinzufügen" und abkühlen, wäre gleichwertig, um es zu entfernen.
Wenn also eine Reaktion exotherm ist und die Temperatur erhöht ist, wäre es wie ein Produkt der Reaktion, so.
Es kann Ihnen dienen: Píchric Acid: Was ist, Struktur, Synthese, EigenschaftenWenn andererseits eine Reaktion endotherm ist und die Temperatur erhöht ist, wäre es wie das Hinzufügen eines Reagenz.
Beispiel:
Die Zersetzungsreaktion von n2ENTWEDER4 Es hat eine +58,0 kJ/Mol -Reaktionenthalpie. In welcher Richtung bewegt sich der Gleichgewicht, wenn die Temperatur verringert wird?
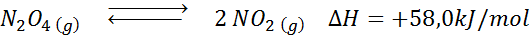
Lösung: Da die Enthalpie positiv ist, ist die Reaktion endotherm. Aus diesem Grund wird das Abkühlen die umgekehrte Reaktion begünstigen, und das Gleichgewicht wird zu den Reagenzien zugänglich, dh zur Bildung von mehr n n2ENTWEDER4.
Wirkung von Katalysatoren, Inhibitoren und inerten Substanzen
Katalysatoren und Inhibitoren beeinflussen die Geschwindigkeit, mit der Reaktionen auftreten, aber sie beeinflussen sowohl die direkte als auch die indirekte Reaktion. Aus diesem Grund wirken sie sich nicht auf den Gleichgewichtszustand aus.
Andererseits wirkt sich die Zugabe einer inerten Substanz als Gas, die nicht mit einer der Reagenzien oder Produkte reagiert, die direkte oder die direkte Reaktion nicht aus.
Anwendung des Prinzips von Le Châtelier
Das Verständnis dieses Prinzips ist sehr nützlich, da es uns ermöglicht, den Zustand des Gleichgewichts einer Reaktion auf unsere Bequemlichkeit zu manipulieren.
In den Fällen, in denen wir interessiert sind.
Das heisst:
- Fügen Sie große Mengen an Reagenzien hinzu, wenn diese wirtschaftlich sind.
- Das Produkt abziehen, während die Reaktion fortschreitet, um das System in einem konstanten Spannungszustand zu erhalten, und immer versucht, die Gleichgewichtsreaktion direkt zu erreichen.
- Erhöhen Sie die Temperatur bei endothermen Reaktionen.
- Erhöhen Sie den Druck auf die Reaktionen, bei denen mehr Gase -Moleküle verbraucht werden als sie auftreten.
Möglicherweise möchten wir auch die Menge eines Produkts minimieren, das durch eine unerwünschte Reaktion gebildet wird. In diesen Fällen tun wir das Gegenteil.
Anwendungsbeispiel des Le Châtelier -Prinzips
In der organischen Synthese wird das Prinzip von Le châtelier ständig verwendet, um die Reaktionenerträge zu verbessern.
Zum Beispiel werden bei Alkoholdehydratationsreaktionen Austrocknung der Umwelt zugesetzt, die das während der Reaktion gebildete Wasser absorbiert. Dies reduziert die Konzentration des Produkts, das das Gleichgewicht zu den Produkten verdrängt.

