Adiabatische Prozesstypen, Beispiele, Übungen gelöst
- 5082
- 783
- Ivan Pressler
A Adiabatischer Prozess Es ist derjenige, bei dem es keinen Wärmeaustausch zwischen dem System und seiner Umgebung gibt, entweder weil es in einem Isoliermedium auftritt oder weil es sehr schnell vorbeikommt. Dies bedeutet, dass in der Umgebung des Systems dies der Teil des untersuchten Universums ist, sollten Temperaturänderungen nicht wahrgenommen werden, sondern nur funktionieren.
Dies ist einer der elementaren Prozesse der Thermodynamik. Im Gegensatz zu den anderen Prozessen (isocorisch, iobarisch und isotherm) bleibt keine seiner physikalischen Variablen konstant; Das heißt.
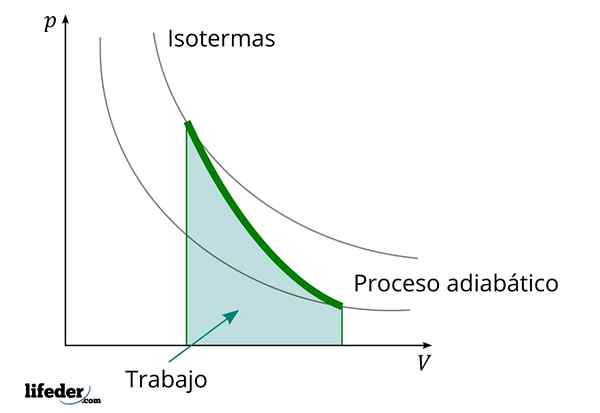
 Während eines adiabatischen Prozesses, bei dem das Volumen zunimmt
Während eines adiabatischen Prozesses, bei dem das Volumen zunimmt Ein weiteres wichtiges Merkmal der adiabatischen Prozesse ist, dass sie proportional zur Variation der internen Energie ihrer Systeme ausführen oder konsumieren. In diesem Fall von denen seiner Moleküle in einer Gasphase. Dies kann dank des ersten Gesetzes der Thermodynamik nachgewiesen werden.
Im täglichen Leben deckt diese Art von Prozess vor allem für geophysikalische Phänomene und in gewissem Maße das Funktionieren von Kolben in den Dieselmotoren ab. Die Wärmeübertragung wird häufig durch die Verwendung eines Isoliermediums verhindert, aber es ist die Geschwindigkeit dieser Prozesse, die ihre reale Entwicklung ermöglicht.
[TOC]
Reversible und irreversible adiabatische Prozesse
Reversibel
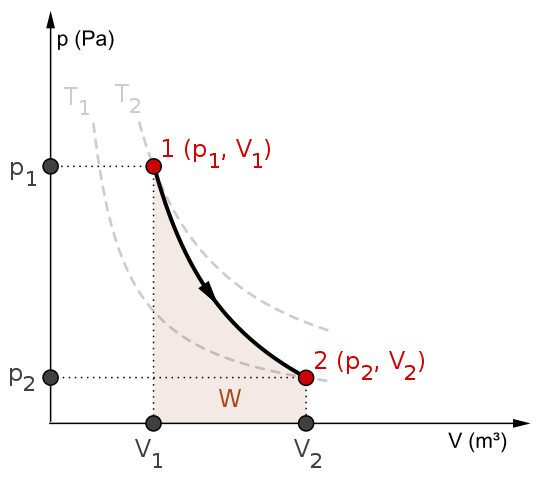 P-V-Diagramm und Arbeit W für einen adiabatischen Prozess. Quelle: Mikerun/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)
P-V-Diagramm und Arbeit W für einen adiabatischen Prozess. Quelle: Mikerun/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0) Adiabatische Prozesse können reversibel oder irreversibel sein. Erstere existieren jedoch nur als theoretische Werkzeuge, um das letztere zu untersuchen. Daher beinhalten die reversiblen adiabatischen Prozesse die idealen Gase und die mangelnde Reibung und alle anderen Eventualitäten, die eine Wärmeübertragung zwischen dem System und seiner Umgebung verursachen.
Betrachten Sie beispielsweise das P-V-Diagramm für den reversiblen adiabatischen Prozess von oben. T1 und T2 entsprechen zwei Isothermen, auf denen der Druck P und die Bände V des Systems variieren.
Unter den Staaten (p)1, V1) Und P2, V2) Eine reversible adiabatische Expansion wird durchgeführt, da wir uns von einem Volumen V bewegen1 zu einem v2, Größer, folgt der Richtung des Pfeils.
Dabei kühlt das System ab, ohne dem Verhalten von Isothermen zu befolgen. Die Fläche unter der Kurve entspricht der Arbeit W, deren Wert positiv ist, weil es sich um eine Erweiterung handelt.
In diesem Prozess bleibt die Entropie konstant und es wird daher gesagt, dass es sichtropisch handelt. Die mathematische Verarbeitung dieser Reversibilität erzeugt eine Reihe von Gleichungen, mit denen es möglich ist, andere Systeme zu bewerten.
Kann Ihnen dienen: Elektrolytische ZellenIrreversibel
Irreversible adiabatische Prozesse sind im Gegensatz zu den reversiblen keine grafischen in den P-V-Diagrammen mit kontinuierlichen, aber gepunkteten Linien, da nur die endgültigen und anfänglichen Zustände ihre Variablen (P, V und T) gut definiert haben. Diese Prozesse umfassen reale Gase, sodass die Gleichung idealer Gase und ihre Ableitungen nicht direkt für sie anwendbar sind.
Sie gehen schnell vorbei und verhindern die Wärmeübertragung zwischen dem System und seiner Umgebung. Auch in ihnen nimmt die Entropie zu, wie im zweiten Gesetz der Thermodynamik angegeben ist.
Beispiele für adiabatische Prozesse
 Die Isolierkapazität, wie die von Thermosmoskapazieren, ist einer der Schlüsselfaktoren für einen Prozess, um adiabatisch zu entwickeln
Die Isolierkapazität, wie die von Thermosmoskapazieren, ist einer der Schlüsselfaktoren für einen Prozess, um adiabatisch zu entwickeln Einige Beispiele für adiabatische Prozesse werden unten erwähnt.
Expansion und Verständnis
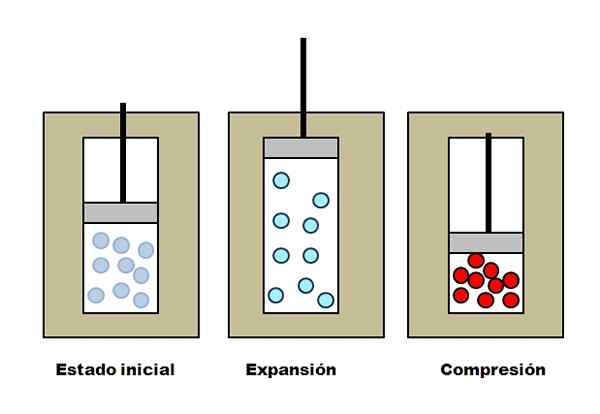 Adiabatische Expansion und Verständnis. Quelle: Gabriel Bolívar.
Adiabatische Expansion und Verständnis. Quelle: Gabriel Bolívar. Nehmen wir drei isolierende Westen an, die Kompartimente voller Gas enthalten. In einem Anfangszustand hat der Kolben keinen Druck auf Gas. Dann darf der Kolben steigen, was das Volumen erhöht, durch das sich die Gasmoleküle bewegen können, was zu einer Abnahme seiner inneren Energie führt. Und daher eine Abnahme der Temperatur.
Das Gegenteil erfolgt bei adiabatischer Komprimierung: Der Kolben führt Arbeiten am Gas durch und verringert das Volumen, das seine Moleküle besetzen können. Die interne Energie nimmt diesmal zu, was auch eine Temperaturanstieg impliziert, deren Wärme aufgrund der isolierenden Weste nicht zur Umgebung verteilt werden kann.
Magma Ascent
Die Kanäle, in denen Magma in einem Vulkan als Isoliermedium aufsteigt, das Wärmeübertragung zwischen Magma und Atmosphäre verhindert.
Sound verbreitete
Die Gase werden gestört und nach der Schallwelle ausgeweitet, ohne die Luft, die sie umgibt.
Foehn -Effekt
Der Feind -Effekt ist ein Beispiel für adiabatische Prozesse im Bereich der Geophysik. Die Luftmassen steigen zum oberen Teil eines Berges auf, wo sie weniger Druck haben, so.
Sie steigen jedoch kaum auf der anderen Seite des Berges hin, der Druck steigt und daher werden die Moleküle komprimiert und erhöhen ihre Temperatur, wodurch die Wolke verschwindet.
Kann Ihnen dienen: Chlobenzol (C6H5cl)Im folgenden Video kann dieses Phänomen geschätzt werden:
Gelöste Übungen
Schließlich werden ein paar Übungen gelöst. Es ist wichtig, die folgenden Gleichungen zur Hand zu haben:
ΔU = Q - W (Erstes Gesetz der Thermodynamik)
Aber keine Wärmeübertragung, q = 0 y:
ΔU = - W (1)
Dies ist: Wenn die Arbeit W positiv ist, ist ΔU negativ und umgekehrt. Andererseits haben wir auch:
W = -NCVΔT (2)
Das nach Anwendung der idealen Gase -Gleichung (PV = NRt) und ersetzen und löst für t2 und T1 wir werden haben:
W = (cV/R) (p1V1 - P2V2) (3)
Der Wert von R gleich 0 sein.082 l · atm/mol · k oder 8.314 j/mol · k
In adiabatischen Prozessen ist es wichtig, die C -Beziehung zu kennenP/CV bekannt als γ:
γ = cP/CV (4)
Dies ermöglicht die Festlegung von T-V- und P-V-Beziehungen:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
Und auch die ungefähren Wärme von CP und CV Sie variieren je nachdem, ob die Gase monoatomisch, diatomisch usw. sind.
Übung 1
Ein Gas führt 600 J Arbeit durch ein isoliertes Fach durch. Was ist die Veränderung seiner inneren Energie?? Nimmt die Temperatur ab oder nimmt zu oder erhöht sich?? Und wenn man bedenkt, dass es sich um ein monoatomisches Gas handelt, berechnen Sie auch γ.
Daten:
W = +600J
ΔU = ¿?
γ =?
W -Arbeit ist positiv, da Gas auf der Umgebung funktioniert. In einem isolierten Kompartiment, q = 0, und deshalb haben wir Gleichung (1):
ΔU = - w
Das heißt, ΔU ist gleich:
ΔU = - (+600J)
= -600J
Was bedeutet, dass die innere Energie von Gas um 600 J abnahm. Wenn ΔU abnimmt, ist auch die Temperatur, so dass das Gas infolge der Arbeit der Arbeit abkühlt.
Weil dieses Gas monoatomisch ist,
CV = 3/2 r
CP = 5/2 r
Und sein
γ = cP/CV
= (5/2 r)/(3/2 r)
= 5/3 oder 1.66
Übung 2
In einem Behälter 7 Mol von o2 Sie wurden von einem Volumen von 15 Litern auf 9 Liter komprimiert. Zu wissen, dass die anfängliche Temperatur 300 K betrug, berechnen Sie: die Arbeiten am Gas.
Daten:
N = 7 Maulwürfe oder2
T1 = 300 k
V1 = 15 l
V2 = 9 l
W = ¿?
Es ist ein irreversibler adiabatisches Verständnis. Wir haben zwei Gleichungen, um W zu lösen:
W = -NCVΔT (2)
W = (cV/R) (p1V1 - P2V2) (3)
Der Druck kann sie berechnen, aber um Zeit zu sparen, ist es besser, mit den ersten Gleichungen fortzufahren:
Kann Ihnen dienen: destilliertes WasserW = -NCVΔt
= -NCV (T2-T1)
Wir brauchen cV und T2 W. Sauerstoff, ein zweistiges Gas, hat ein cV gleich 5/2 r:
CV (ENTWEDER2) = 5/2 r
= 5/2 (8.314 j/mol · k)
= 20.785 j/mol · k
Wir müssen t berechnen2. Wir wenden uns der Gleichung (5) zu:
T1V1γ-1 = T2V2γ-1
Aber bevor Sie es verwenden, müssen Sie zuerst c bestimmen cP und γ:
CP (ENTWEDER2) = 7/2 r
= 7/2 (8.314 j/mol · k)
= 29.099 j/mol · k
Γ gleich sein:
γ = cP/CV
= (29.099 j / mol · k) / 20.785 j/mol · k
= 1.4
Also können wir das klären2 Aus Gleichung (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300k) (15 l)1.4-1] / (9l)1.4-1
= 368.01 K
Und schließlich lösen wir für W:
W = -NCVΔt
= -(7 mol o o2)( zwanzig.785 J/Mol · k) (368.01 K - 300 K)
= -9895.11 J O -9.895 KJ
Übung 3
Ein Neonbehälter erweitert adiabatisch und zunächst bei Raumtemperatur (t = 298K) von 12 l bis 14 l. Zu wissen, dass sein anfänglicher Druck 3 atm betrug, was wird die Arbeit des Gases sein?
Daten:
T1 = 298 K
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
Gleichung (3) ermöglicht es uns, W mit den Werten des Drucks zu bestimmen:
W = (cV/R) (p1V1 - P2V2)
Aber wir fehlen cV Und P2.
Der endgültige Druck kann mit Gleichung (6) berechnet werden:
P1V1γ = P2V2γ
Γ gleich c gleich cP/CV. Da Neon ein monoatomisches Gas ist, haben wir seine C -WerteP und CV Sie sind 5/2R bzw. 3/2r. Wir berechnen dann γ:
γ = cP/CV
= (5/2r)/(3/2r)
= 5/3 oder 1.66
Wir klären p2 Aus Gleichung (6):
P2 = (P1V1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 atm
Und die Arbeit wird gleich sein:
W = (cV/R) (p1V1 - P2V2)
= (3/2) [(3 atm) (12 l) - (1.40 atm) (14 l)] (101300 Pa/1 atm) (0).001 m3/L) (KJ/1000 J)
= 2.49 KJ
Konvertierungsfaktoren werden verwendet, um den l · atm a pa · m zu konvertieren3, das entspricht 1 J. Neongas dehnt sich aus, so dass sein Druck abnimmt, und bei der Arbeit an der Umgebung ist dies positiv. Auch seine interne Energie ΔU nimmt sowie seine Temperatur ab und kühlt den Expansionsprozess ab.
Verweise
- Walter J. Moore. (1963). Physikalische Chemie. In der chemischen Kinetik. Vierte Ausgabe, Longmans.
- Iran. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe. Mc Graw Hill.
- Wikipedia. (2020). Adiabatischer Prozess. Abgerufen von: in.Wikipedia.Org
- Jones, Andrew Zimmerman. (18. August 2020). Theodynamics: adiabatischer Prozess. Erholt von: thoughtco.com
- Devoe Howard & Neils Tom. (9. August 2020). Adiabatische Veränderungen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- « Was ist das mechanische Äquivalent von Wärme??
- Maderismo -Geschichte, Ideologie, Vertreter, Konsequenzen »

