Isobarische Prozessformeln, Gleichungen, Experimente, Übungen

- 1979
- 159
- Tizian Liebich
In einem isobarischer Prozess, der Druck P eines Systems bleibt konstant. Das Präfix "ISO" stammt aus dem Griechischen und wird verwendet, um zu bezeichnen, dass etwas konstant bleibt, während "Baros", ebenfalls aus Griechisch, Gewicht bedeutet.
Die iobarischen Prozesse sind sowohl in geschlossenen Behältern als auch in offenen Räumen sehr eigen, sodass sie einfach in der Natur lokalisieren können. Damit meinen wir, dass physikalische und chemische Veränderungen auf der irdischen Oberfläche oder chemischen Reaktionen in offenen Behältern zur Atmosphäre möglich sind.
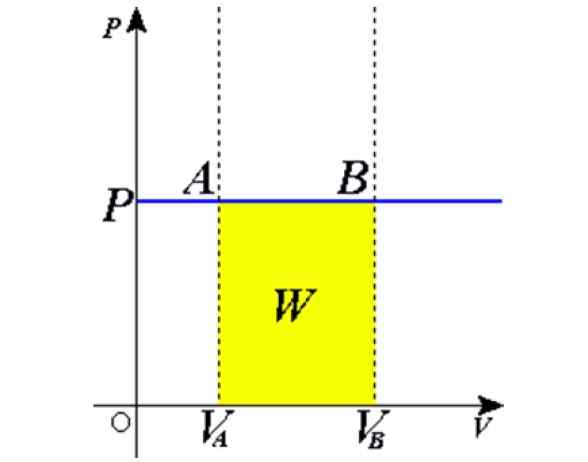 Abbildung 1. Isobaric -Prozess: Die blaue horizontale Linie ist eine Isobrara, was einen konstanten Druck bedeutet. Quelle: Wikimedia Commons.
Abbildung 1. Isobaric -Prozess: Die blaue horizontale Linie ist eine Isobrara, was einen konstanten Druck bedeutet. Quelle: Wikimedia Commons. Einige Beispiele werden durch Erhitzen auf die Sonne ein Ballon voller Luft, Kochen, Kochen oder Einfrieren von Wasser, der Dampf, der in den Kesseln erzeugt wird, oder beim Anheben eines Heißluftballons erhalten. Später werden wir eine Erklärung dieser Fälle geben.
[TOC]
Formel und Gleichungen
Wir leiten eine Gleichung für den iobarischen Prozess ab, unter der Annahme, dass das untersuchte System ein ideales Gas ist, ein ziemlich geeignetes Modell für fast jedes Gas mit weniger als 3 Druckatmosphären. Die idealen Gaspartikel bewegen sich zufällig und besetzen das gesamte Volumen des Raums, der sie enthält, ohne miteinander zu interagieren.
Wenn das ideale Gas, das in einem mit einem beweglichen Kolben versehenen Zylinder eingesperrt ist. Dann übt das Gas den Flächenkolben aus ZU eine Kraft F Größe:
F = p.ZU
Wo P Es ist Gasdruck. Diese Kraft übt einen Job aus, der eine infinitesimale Verschiebung hervorbringt Dx Im Kolben gegeben von:
dw = fdx = pa.Dx
Wie das Produkt ADX Es ist ein Volumenunterschied Dv, So DW = PDV. Es bleibt bleibt, beide Seiten aus dem Anfangsvolumen zu integrieren VZU Bis zum letzten Volumen VB Um die Gesamtarbeiten des Gas zu erhalten:


[TOC]
Experimente
Die beschriebene Situation wird experimentell verifiziert, um ein Gas innerhalb eines mit einem beweglichen Kolben versehenen Zylinders zu konfigurieren, wie in den Abbildungen 2 und 3 gezeigt. Ein Kolben wird auf den Kolben gelegt, dessen Gewicht nach unten gerichtet ist, während das Gas dank des P -Drucks, der auf dem Kolben produziert, eine Kraft ausübt.
Es kann Ihnen dienen: Nachahmung: Was besteht, Methode und Beispiele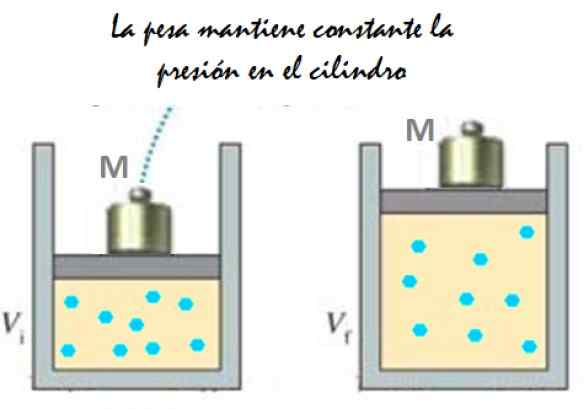 Figur 2. Experiment, das aus der Erweiterung eines konstanten Druckgases besteht. Quelle: f. Zapata.
Figur 2. Experiment, das aus der Erweiterung eines konstanten Druckgases besteht. Quelle: f. Zapata. Da sich der Kolben frei bewegen kann, kann sich das Volumen, das Gas einnimmt. Hinzufügen von atmosphärischem Druck pGeldautomat, Das übt auch eine Kraft aus, Sie haben:
Mg - p.A + pGeldautomat . A = konstant
Daher: p = (mg/a) + pGeldautomat Es variiert nicht, es sei denn m und damit das Gewicht modifiziert. Wenn das Gas Wärme in den Zylinder addiert, wird das Volumen erhöht oder es wird sich bei der Extraktion der Wärme zusammenziehen.
Isobarische Prozesse im idealen Gas
Die ideale Gasstatusgleichung bezieht sich Wichtigkeitsvariablen: Druck P, Volumen V und Temperatur t:
P.V = n .R.T
Hier repräsentiert N die Anzahl der Mol und R die Konstante der idealen Gase (gültig für alle Gase), die durch Multiplizieren der Boltzmann -Konstante mit der Avogadro -Zahl berechnet wird, was zu:
R = 8.31 j/mol k k
Wenn der Druck konstant ist, kann die Zustandsgleichung geschrieben werden als:
V/t = nr/p
Aber nr/p ist konstant, da n, r und p sind. Wenn das System also von einem Staat 1 zu einem anderen Staat 2 übergeht, entsteht der folgende Anteil, auch bekannt als Charles 'Gesetz:
V1/T1 = V2/T2
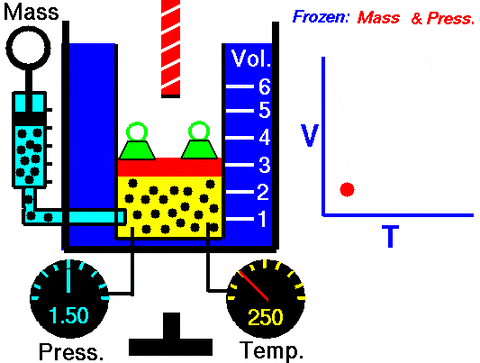 Figur 3. Animation, die die Ausdehnung von konstantem Druckgas zeigt. Rechts die Grafik des Volumens in Abhängigkeit von der Temperatur, bei der es sich um eine Linie handelt. Quelle: Wikimedia Commons. Glenn Research Center der NASA [Public Domain].
Figur 3. Animation, die die Ausdehnung von konstantem Druckgas zeigt. Rechts die Grafik des Volumens in Abhängigkeit von der Temperatur, bei der es sich um eine Linie handelt. Quelle: Wikimedia Commons. Glenn Research Center der NASA [Public Domain]. Austausch in W = pδv, Die Arbeiten für den Zustand 1 bis 2 in Bezug auf die Konstanten und die Temperaturschwankungen, die mit einem Thermometer leicht zu messen sind:
W1 → 2 = nr (t2 - T1) = nr.Δt
Andererseits legt das erste Gesetz der Thermodynamik fest:
∆U = q - w
Dies bedeutet, dass die innere Energie ∆U zu dem Gas eine gewisse Wärme -Q -Menge erhöht und die Schwingungen seiner Moleküle zunehmen. Auf diese Weise erweitert Gas und führt Arbeit durch, indem er den Kolben verdrängt, wie wir bereits gesagt haben.
In einem idealen monoatomischen Gas und der Variation der inneren Energie ∆U, die sowohl die kinetische Energie als auch die potenzielle Energie seiner Moleküle umfasst, beträgt:
∆U = (3/2)Nr δt
Schließlich kombinieren wir in einem die Ausdrücke, die wir erhalten haben:
Q = ∆u + w = (3/2)Nr δt + Nr∆t = ((5/2) Nr δt
Alternativ kann dies in Bezug auf die Masse m, die Temperaturdifferenz und eine neue Konstante genannt werden Spezifische Wärmewärme Bei konstantem Druck wurde c c abkürzteP, deren Einheiten J/Mol K sind:
Kann Ihnen dienen: Venus (Planet)Q = m cP ∆t
Beispiele
Nicht alle isobaren Prozesse werden in geschlossenen Behältern durchgeführt. Tatsächlich treten unzählige thermodynamische Prozesse aller Arten von Atmosphärendruck auf, sodass die isobaren Prozesse von Natur aus sehr häufig sind. Dies beinhaltet physikalische und chemische Veränderungen auf der Erdoberfläche, chemische Reaktionen in offenen Behältern und vieles mehr.
Damit isobare Prozesse in geschlossenen Systemen auftreten können, ist es notwendig, dass ihre Grenzen flexibel genug sind, um Änderungen des Volumens ohne den Druck zu ermöglichen.
Dies geschah im Kolbenexperiment, das sich leicht bewegte, wenn sich das Gas ausdehnte. Das Gleiche geschieht, indem ein Gas in einer Party für Partys oder einen Heißluftballon eingeschlossen wird.
Hier haben wir mehrere Beispiele für iobarische Prozesse:
Wasser kochen und kochen
Kochen Wasser für Tee oder Kochsaucen in offenen Behältern sind gute Beispiele für iobarische Prozesse, da sich jeder im atmosphärischen Druck entwickelt.
Beim Erhitzen des Wassers, der Temperatur und des Volumens und bei Fortsetzung des Wärme. In diesem Fall bleibt die Temperatur auch konstant von 100 º C.
Einfrieren von Wasser
Auf der anderen Seite ist das Einfrieren von Wasser auch ein isobarischer Prozess, egal ob es im Winter oder im Hauskühlschrank in einem See stattfindet.
Erhitzen Sie einen Ballon voller Luft zur Sonne
Ein weiteres Beispiel für den iobarischen Prozess ist die Änderung des Volumens eines Luftballons, der der Sonne ausgesetzt ist. Als erstes morgens, wenn es nicht sehr heiß ist, hat der Globus eine bestimmte Lautstärke.
Mit der Zeit und der Temperatur erhöht auch der Globus, der das Volumen erhöht, und all dies geschieht unter konstantem Druck. Das Globusmaterial ist ein gutes Beispiel für die flexible Rand, die flexibel genug ist, um die Luft im Inneren zu machen, wenn er erhitzt wird, ohne den Druck zu modifizieren.
Die Erfahrung kann auch durchgeführt werden, indem der Globus im Höhepunkt einer Glasflasche mit einem Drittel Wasser, das auf Maria Bio Bio von Mary erhitzt wird. Sobald das Wasser erhitzt wird, wird der Ballon sofort aufgeblasen, aber es sollte darauf geachtet werden, nicht zu viel zu heizen, damit er nicht explodiert.
Der aerostatische Ballon
Es ist ein schwimmendes Schiff ohne Antrieb, das Luftströmungen verwendet, um Menschen und Gegenstände zu transportieren. Der Globus ist normalerweise mit heißer Luft gefüllt, die kälter als die umgebende Luft ist, steigt und erweitert den Globus rau.
Kann Ihnen dienen: Triple PointWährend Luftströme direkt auf den Globus sind, verfügt es über Brenner, die aktiviert werden, um das Gas zu erwärmen, wenn Sie die Höhe aufsteigen oder aufrechterhalten möchten, und werden beim Abstieg oder Landung deaktiviert. All dies geschieht bei atmosphärischem Druck, der in einer bestimmten Höhe nicht weit von der Oberfläche konstant angesehen wird.
 Figur 4. Heißluftballons. Quelle: Pixabay.
Figur 4. Heißluftballons. Quelle: Pixabay. Kessel
In den Kesseln wird Dampf durch Erhitzen von Wasser und die Aufrechterhaltung des konstanten Drucks erzeugt. Dann erzeugt dieser Dampf einen nutzbaren Job, beispielsweise erzeugt Strom in thermoelektrischen Pflanzen oder wirkt anderer Mechanismen wie Lokomotiven und Wasserpumpen.
Gelöste Übungen
Übung 1
Es gibt 40 Liter Gas bei 27 ° C Temperatur. Finden Sie die Volumenzunahme beim Zugabe von Wärme isobárisch, bis es 100 ºC erreicht.
Lösung
Das Charles 'Gesetz wird verwendet, um das endgültige Volumen zu bestimmen, aber die Aufmerksamkeit: Temperaturen müssen in Kelvin ausgedrückt werden. Fügen Sie jeweils nur 273 K hinzu:
27 ºC = 27 + 273 k = 300 K
100 ºC = 100 + 273 k = 373 K
Aus:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ºC (40 l/300 K) = 49.7 l
Schließlich ist der Volumenerhöhung v2 - V1 = 49.7 l - 40 l = 9.7 l.
Übung 2
5 werden geliefert 5.00 x 103 J von Energie zu einem idealen Gas für die Herstellung 2.00 x 103 J Arbeiten an Ihrer Umgebung in einem isobaren Prozess. Es wird gebeten zu finden:
a) Die Veränderung der inneren Energie von Gas.
b) Die Volumenänderung, wenn jetzt die interne Energie um 4 abnimmt.50 x 103 J und 7 werden ausgeschlossen.50 x 103 J des Systems unter Berücksichtigung eines konstanten Drucks von 1.01 x 105 Pa.
Lösung für
Gebraucht ∆U = q - w und die in der Anweisung angegebenen Werte werden ersetzt: Q = 5.00 x 103 J und W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Daher steigt die innere Energie von Gas um 3 um 3.00 x 103 J.
Lösung b
Die Volumenänderung findet sich in den durchgeführten Arbeiten: W = p∆v:
∆U = q - w = q - P∆v
Die Aussage bestätigt, dass die interne Energie daher abnimmt: ∆U= -4.50 x 103 J. Es zeigt uns auch, dass eine gewisse Wärmemenge ausgestoßen ist: q = -7.50 x 103 J. In beiden Fällen stellt das negative Vorzeichen eine Abnahme und den Verlust dar, dann:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Wo P = 1.01 x 105 Pa. Da sich alle Einheiten im internationalen System befinden, ist die Volumenänderung klar:
∆V = ((-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Pa) = -2.97 x 10-2 M3
Da die Volumenänderung negativ ist, bedeutet dies, dass das Volumen abnahm, dh das System hat sich zusammengeschlossen.
Verweise
- Byjou's. Isobarischer Prozess. Erholt von: Byjus.com.
- Cengel, und. 2012. Thermodynamik. 7. Ausgabe. McGraw Hill.
- XYZ -Prozess. Erfahren Sie mehr über den iobarischen Prozess. Erholt von: 10Prozess.X und z.
- Serway, r., Vulle, c. 2011. Grundlagen der Physik. 9na ed. Cengage Lernen.
- Wikipedia. Gasgesetze. Geborgen von: ist.Wikipedia.Org.
- « 14 Psychologische Experimente mit sehr kontroversen Menschen
- Verspannungskonzept, Typen und Beispiele »

