Isocorischer Prozess
- 1280
- 317
- Joe Hartwig
Was ist ein isocorischer Prozess?
A Isocorischer Prozess Es ist ein thermodynamischer Prozess, bei dem das Volumen konstant bleibt. Diese Prozesse erhalten häufig auch den Namen isometrisch oder isovolumetrisch. Im Allgemeinen kann ein thermodynamischer Prozess bei konstantem Druck auftreten und wird dann als isobarisch bezeichnet.
Wenn es bei konstanter Temperatur auftritt, wird in diesem Fall gesagt, dass es sich um einen isothermen Prozess handelt. Wenn es keinen Wärmeaustausch zwischen dem System und der Umgebung gibt, wird die Rede von Adiabatic reagiert. Andererseits wird der erzeugte Prozess, wenn es ein konstantes Volumen gibt, isocorisch bezeichnet.

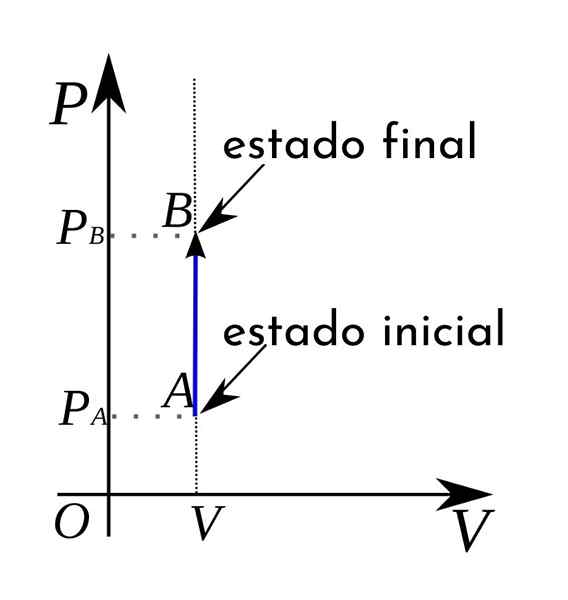
Im Falle des isocorischen Prozesses kann bestätigt werden, dass in diesen Prozessen die Druck-Volumen-Arbeit ungültig ist.
Darüber hinaus werden die isocorischen Prozesse in einem thermodynamischen Druck-Volumen-Diagramm in Form einer vertikalen geraden Linie dargestellt.
Formeln und Berechnung
Das erste Prinzip der Thermodynamik
In der Thermodynamik wird die Arbeit aus dem folgenden Ausdruck berechnet:
W = p ∙ ∆ v
In diesem Ausdruck ist w die in Joule gemessen.
Ebenso legt das bekannte als erste Prinzip der Thermodynamik fest:
∆ u = q - w
In dieser Formel mit der Arbeit, die das System oder das System erledigt hat, ist die vom System empfangene oder ausgegebene Wärme und ∆ u Es ist die interne Energievariation des Systems. Bei dieser Gelegenheit werden die drei Größen in Joule gemessen.
Da in einem isocorischen Prozess die Arbeit Null ist, stellt sich heraus, dass es erfüllt ist:
Kann Ihnen dienen: Neptun (Planet)∆ u = qV (Da ∆ v = 0 und daher w = 0)
Das heißt. In diesem Fall wird die übertragene Wärme als Wärme als konstantes Volumen bezeichnet.
 Wärmekapazität bei konstantem Volumen
Wärmekapazität bei konstantem Volumen
Die Wärmekapazität eines Körpers oder eines Systems ergibt sich aus der Aufteilung der Energiemenge in Form von Wärme, die in einen bestimmten Prozess in einen Körper oder ein System übertragen werden.
Wenn der Vorgang mit konstantem Volumen durchgeführt wird, wird er von Wärmekapazität zum konstanten Volumen gesprochen und mit C bezeichnetv (Molarenwärmekapazität).
Es wird in diesem Fall erfüllt:
Qv = N ∙ cv ∙ ∆t
In dieser Situation ist n die Anzahl der Maulwürfe, cv Es ist der oben genannte Wärmekapazitätsmolar bis zu konstant.
Tägliche Beispiele für isocorische Prozesse
Es ist leicht vorstellbar, einen isocorischen Prozess zu machen, es ist nur notwendig, sich einen Prozess vorzustellen, der bei konstantem Volumen auftritt. Das heißt, in dem der Behälter, der das Material oder das Materialsystem enthält.
Ein Beispiel könnte der Fall sein (ideal) in einem geschlossenen Behälter gesperrt, dessen Volumen auf keinen Fall geändert werden kann, der Wärme geliefert wird. Angenommen, der Fall eines in einer Flasche eingesperrten Gas.
Durch die Übertragung von Wärme in Gas wird es, wie bereits erläutert, zu einer Erhöhung oder Erhöhung seiner inneren Energie führt.
Der umgekehrte Prozess wäre der eines in einem Behälter eingeschlossenen Gas, dessen Volumen nicht geändert werden kann. Wenn das Gas abkühlt und der Umwelt Wärme verleiht, würde der Gasdruck und der Wert der inneren Energie des Gases verringert werden.
Es kann Ihnen dienen: Diskrete Variable: Eigenschaften und BeispieleDer ideale Zyklus otto
Der Otto -Zyklus ist ein idealer Fall des Zyklus, der von Benzinmaschinen verwendet wird. Die erste Verwendung war jedoch in den Maschinen, die Erdgas oder andere Brennstoffe in einem gasförmigen Zustand verwendeten.
In jedem Fall ist Ottos idealer Zyklus ein interessantes Beispiel für den isocorischen Prozess. Es tritt bei einem Verbrennungsauto auf.
In diesem Fall erfolgt eine Erhöhung der Temperatur und des Gasdrucks innerhalb des Zylinders und bleibt das konstante Volumen.
Praktische Beispiele
Erstes Beispiel
Geben Sie ein (ideal) in einem mit einem Kolben versandten Gas (ideal) an, ob die folgenden Fälle Beispiele für isocorische Prozesse sind.
- Eine 500 -J -Arbeit an Gas ist erledigt.
In diesem Fall wäre es kein isocorischer Prozess, da es erforderlich ist, ihn zu komprimieren und damit sein Volumen zu ändern.
- Das Gas erweitert den Kolben horizontal.
Auch hier wäre es kein isocorischer Prozess, da die Gaserweiterung eine Variation seines Volumens impliziert.
- Der Zylinderkolben ist festgelegt, damit das Gas nicht bewegt werden kann und das Gas abgekühlt ist.
Bei dieser Gelegenheit wäre es ein isocorischer Prozess, da es keine Volumenvariation geben würde.
Zweites Beispiel
Bestimmen Sie die Variation der internen Energie, bei der ein in einem Behälter enthaltenes Gas mit einem Volumen von 10 l Druck auf 1 atm Druck auftritt, wenn seine Temperatur in einem Isocoric -Prozess von 34 ° C bis 60 ° C steigt, in einem isocorischen Prozess, bekannt sein spezifisches Wärmenmolarwärme Cv = 2.5 ·R (Sein R = 8.31 j/mol · k).
Es kann Ihnen dienen: Graff Van Generator: Partys, wie es funktioniert, AnwendungenDa es sich um einen konstanten Volumenprozess handelt, tritt die interne Energieschwankung nur infolge der Wärme zu Gas auf. Dies wird mit der folgenden Formel bestimmt:
Qv = N ∙ cv ∙ ∆t
Um die gelieferte Wärme zu berechnen, muss zunächst die im Behälter enthaltenen Gasmolen berechnet werden. Dazu ist es notwendig, auf die Gleichung idealer Gase zurückzugreifen:
P ∙ v = n ∙ r ∙ t
In dieser Gleichung n ist die Anzahl der Mol, R eine Konstante, deren Wert 8,31 J/Mol · k beträgt, t die Temperatur, p ist der Druck, für den das in Atmosphären gemessene Gas und t ausgesetzt sind und T die gemessene Temperatur ist in Kelvin.
Es wird gelöscht und erhalten:
n = r ∙ t/ (p ∙ v) = 0, 39 Moles
So dass:
∆ u = qV = N ∙ cv ∙ ∆t = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J

