Politrope Prozessmerkmale, Anwendungen und Beispiele

- 3428
- 954
- Jasmine Kupprion
A Politropischer Prozess Es ist ein thermodynamischer Prozess, der auftritt, wenn die Beziehung zwischen Druck P und das Volumen V gegeben durch P.VN Es bleibt konstant. Der Exponent N Es ist eine reelle Zahl, im Allgemeinen zwischen Null und Unend, dass dies in einigen Fällen jedoch negativ sein kann.
Der Wert von N den Namen von erhalten Politropy Index Und es ist wichtig hervorzuheben, dass der Index während eines polytropen thermodynamischen Prozesss einen festen Wert beibehalten muss.
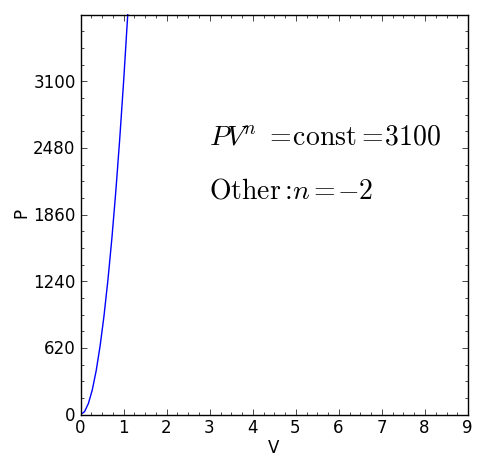
 Abbildung 1. Charakteristische Gleichung eines polytropischen thermodynamischen Prozesss. Quelle: f. Zapata.
Abbildung 1. Charakteristische Gleichung eines polytropischen thermodynamischen Prozesss. Quelle: f. Zapata. [TOC]
Eigenschaften polytropischer Prozesse
Einige charakteristische Fälle von polytropischen Prozessen sind:
- Der isotherme Prozess (bei konstanter T -Temperatur), bei dem der Exponent n = 1 ist.
- Ein iobarischer Prozess (konstanter Druck P), in diesem Fall n = 0.
- Der isocorische Prozess (zu Volumen v Konstante), für den n =+∞.
- Adiabatische Prozesse (zur konstanten Entropie), bei denen der Exponent n = γ ist und γ die adiabatische Konstante ist. Diese Konstante ist der Quotient zwischen der Wärmekapazität bei konstantem Druck CP geteilt durch die Wärmekapazität bei konstantem CV -Volumen:
γ = CP/CV
- Ein anderer thermodynamischer Prozess, der keiner der vorherigen Fälle ist. Aber einhalten P.VN = ctte Mit realem und konstantem polytropem Index N Es wird auch ein polytropischer Prozess sein.
 Figur 2. Verschiedene charakteristische Fälle von polytropischen thermodynamischen Prozessen. Quelle: Wikimedia Commons.
Figur 2. Verschiedene charakteristische Fälle von polytropischen thermodynamischen Prozessen. Quelle: Wikimedia Commons. Anwendungen
Eine der Hauptanwendungen der polytropischen Gleichung ist die Berechnung der Arbeiten eines geschlossenen thermodynamischen Systems, wenn es von einem Anfangszustand zu einem anderen Ende auf quasi -statische Weise übergeht, dh nach einer Folge von Gleichgewichtszuständen.
Arbeiten in polytropischen Prozessen für verschiedene Werte von N
Für n ≠ 1
Mechanische Arbeiten werden von einem geschlossenen thermodynamischen System durchgeführt werden, wird durch Expression berechnet:
W = ∫p.Dv
Kann Ihnen dienen: Diamagnetismus: Materialien, Anwendungen, BeispieleWobei P der Druck und V das Volumen ist.
Wie bei einem polytropischen Prozess beträgt der Zusammenhang zwischen Druck und Volumen:
P.V N = konstant = c
Löschen von P des vorherigen Ausdrucks, um ihn im Ausdruck von Arbeit zu ersetzen:
P = c /V N
Sie haben die mechanische Arbeit während eines polytropischen Prozesses erledigt, der in einem Anfangszustand 1 beginnt und im endgültigen Zustand 2 endet. All dies erscheint im folgenden Ausdruck:

\left&space;[V_2^1-n-V_1^1-n&space;\right&space;])
C = p1 V1N = P2 V2N
Durch das Ersetzen des Wertes der Konstante im Ausdruck von Arbeit wird er erhalten:
W = (p)2 V2 - P1 V1)/(1-n)
Für den Fall, dass die Arbeitssubstanz als ideales Gas modelliert werden kann, ist die folgende Zustandsgleichung:
P.V = m.R.T
Wobei m die Anzahl der Mol idealen Gas und R die universelle Konstante der Gase ist.
Für ein ideales Gas, das einem polytropen Prozess mit einem Polytropie -Index von der Einheit unterscheidet und von einem Zustand mit Anfangstemperatur t übergeht1 zu einem anderen Zustand mit Temperatur t2 Die geleistete Arbeit erfolgt durch die folgende Formel:
W = m r (t2 - T1)/(1-n)
Für n → ∞
Gemäß der Formel für die im vorherigen Abschnitt erhaltenen Arbeiten ist die Arbeit eines polytropen Prozesses mit n = ∞ null, da der Ausdruck der Arbeit zwischen unendlich und daher das Ergebnis auf Null getrennt ist.
Eine andere Möglichkeit, dieses Ergebnis zu erreichen, besteht darin, von der P -Beziehung aus zu beginnen1 V1N = P2 V2N, die wie folgt umgeschrieben werden können:
(P1/P2) = (V2/V1)N
N-Dicker-Wurzel in jedem Mitglied nehmen, das Sie erhalten:
(V2/V1) = (p)1/P2)(1/n)
In dem Fall, dass n → ∞, müssen Sie (v2/V1) = 1, was bedeutet:
Kann Ihnen dienen: Abgezeded Wärme: Formeln, wie man sie berechnet und Übungen gelöstV2 = V1
Das heißt, das Volumen ändert sich in einem polytropischen Prozess nicht mit n → ∞. Daher beträgt das DV -Volumenunterschied im Integral der mechanischen Arbeit 0. Diese Arten von polytropischen Prozessen werden auch als Prozesse bezeichnet Isocoric, o Prozesse bei konstantem Volumen.
Für n = 1
Auch hier haben wir den Ausdruck für die Arbeit:
W = ∫p dv
Bei einem polytropischen Prozess mit n = 1 beträgt die Beziehung zwischen Druck und Volumen:
P v = konstant = c
Indem Sie P des vorherigen Ausdrucks beseitigen und ersetzen, haben Sie die Arbeiten, um vom Anfangszustand 1 zum endgültigen Zustand 2 zu wechseln:

Das heißt:
W = c ln (v2/V1).
Da die anfänglichen und endgültigen Zustände gut bestimmt sind, wird auch die CTTE. Das heißt:
C = p1 V1 = P2 V2
Schließlich stehen die folgenden nützlichen Ausdrücke zur Verfügung, um die mechanische Arbeit eines polyitropen geschlossenen Systems zu ermitteln, in dem n = 1.
W = p1 V1 ln (v2/V1) = P2 V2 ln (v2/V1)
Wenn die Arbeitssubstanz besteht aus M Mol ideale Gas, dann kann die ideale Gasgleichung angewendet werden: P V = m.R.T.
In diesem Fall wie p.V1 = CTTE, ein polytropischer Prozess mit n = 1 ist ein Prozess bei konstanter T -Temperatur (isotherm), so dass die folgenden Ausdrücke für die Arbeit erhalten werden können:
W = m r t1 ln (v2/V1) = m r t2 ln (v2/V1)
 Figur 3. Ein Caramban -Schmelzen, Beispiel für isothermen Prozess. Quelle: Pixabay.
Figur 3. Ein Caramban -Schmelzen, Beispiel für isothermen Prozess. Quelle: Pixabay. Beispiele für polytropische Prozesse
- Beispiel 1
Nehmen Sie einen Zylinder mit einem beweglichen Kolben mit einem Kilogramm Luft an. Zunächst nimmt die Luft ein Volumen V ein1= 0,2 m3 bei einem Druck p1= 400 kPa. Ein polytropischer Prozess wird mit n = γ = 1,4 verfolgt, dessen endgültiger Zustand Druck p hat2 = 100 kPa. Bestimmen Sie die von der Luft am Kolben geleisteten Arbeiten.
Lösung
Wenn der Polytropie -Index gleich der adiabatischen Konstante ist, gibt es einen Prozess, bei dem die Arbeitssubstanz (Luft) keine Wärme mit der Umgebung austauscht und daher die Entropie nicht ändert.
Es kann Ihnen dienen: drittes Gesetz der Thermodynamik: Formeln, Gleichungen, BeispieleFür Luft, ein ideales Diatomgas, haben Sie:
γ = cp/cv, mit CP = (7/2) r und cv = (5/2) r
So:
γ = 7/5 = 1,4
Unter Verwendung der Expression des polytropischen Prozesses kann das endgültige Volumen der Luft bestimmt werden:
V2 = [P2 V11.4)/P2](1/1,4) = 0,54 m3.
Jetzt gibt es Bedingungen, um die Arbeitsformel in einem oben erhaltenen polytropischen Prozess für n üssel 1 anzuwenden:
W = (p)2 V2 - P1 v1)/(1-n)
Das Ersetzen der entsprechenden Werte sind:
W = (100 kPa 0,54 m)3 - 400 kPa 0,2 m3)/(1 - 1,4) = 65,4 kJ
- Beispiel 2
Nehmen Sie den gleichen Zylinder von Beispiel 1 mit einem beweglichen Kolben mit einem Kilogramm Luft an. Zunächst nimmt die Luft ein Volumen v1 = 0,2 m ein3 bei einem Druck P1 = 400 kPa. Aber im Gegensatz zu dem vorherigen Fall erweitert sich die Luft isotherm, um einen endgültigen Druck P2 = 100 kPa zu erreichen. Bestimmen Sie die von der Luft am Kolben geleisteten Arbeiten.
Lösung
Wie bereits gesehen, sind isotherme Prozesse polytropische Prozesse mit Index n = 1, sodass es erfüllt ist, dass:
P1 v1 = p2 v2
Auf diese Weise kann das endgültige Volumen leicht abgelöst werden, um zu erhalten:
V2 = 0,8 m3
Wenn Sie dann den Ausdruck der zuvor für den Fall erhaltenen Arbeiten n = 1 verwenden, müssen Sie in diesem Prozess an der Luft am Kolben arbeiten:
W = p1 v1 ln (v2/v1) = 400000 pa × 0,2 m3 ln (0,8/0,2) = 110,9 kJ.
Verweise
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 1. Mc Graw Hill.
- Cengel, und. 2012. Thermodynamik. 7. Ausgabe. McGraw Hill.
- Figueroa, d. (2005). Serie: Physik für Wissenschaft und Ingenieurwesen. Band 4. Flüssigkeiten und Thermodynamik. Herausgegeben von Douglas Figueroa (USB).
- López, c. Das erste Gesetz der Thermodynamik. Erholt von: Culturacientifica.com.
- Ritter, r. 2017. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz. Pearson.
- Serway, r., Vulle, c. 2011. Grundlagen der Physik. 9na ed. Cengage Lernen.
- Sevilla University. Wärmemaschinen. Erholt von: Laplace.uns.Ist.
- Wikiwand. Politropischer Prozess. Erholt von: Wikiwand.com.
- « Forschungsstudie Was ist Typen und Beispiele, Beispiele
- Abgrenzung des Forschungsthemas, was und Beispiele bestehen »

