Prolineigenschaften, Struktur, Funktionen, Lebensmittel
- 2028
- 596
- Ivan Pressler
Der Prolin (Pro, p) gehört zu den 22 Aminosäuren, die als Basic klassifiziert sind. Es ist eine nicht essentielle Aminosäure, da sie von Menschen und anderen Säugetieren synthetisiert werden kann.
Im Jahr 1900 war der deutsche Wissenschaftler Richard Willstatter der erste, der den Prolin extrahierte und beobachtete. Es war jedoch 1901 Emili Fischer, der den Begriff "Prolin" basierte, der auf dem Pyrrolidinring der Aminosäure basierte. Dieser Forscher gelang es auch, die Synthese des Prolins aus dem Milchkasein ausführlich zu erklären.
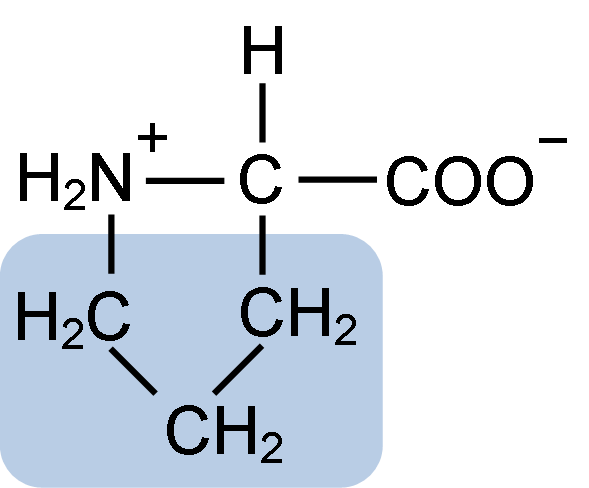
 Chemische Struktur von Prolinaminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Chemische Struktur von Prolinaminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) In Proteinen wie Kasein hat Prolin eine unverzichtbare Funktion in "Kurven" und strukturelle Faltung. In diesem Protein ist das Prolin homogen in der Struktur verteilt und verbindet sich mit dem β -Kasein und dem αS1 -Protein; Darüber hinaus verhindert es defekte strukturelle Schleifen oder Falten.
In den derzeit verwendeten biochemischen Analysen zur Bestimmung der genauen Sequenz von Aminosäuren, aus denen die Proteine besteht.
Skorbut ist vielleicht die bekannteste Krankheit im Zusammenhang mit Proline. Dies hat mit einem Mangel an Vitamin C -Aufnahme zu tun, der direkt die Hydroxylierung des Prolins in den Kollagenfasern beeinflusst, was aufgrund der Instabilität der Kollagenfasern, die sich im Körper befinden, eine systemische Schwächung verursacht.
[TOC]
Eigenschaften
Die sekundäre Aminogruppe α von Carbon -Bound macht die Prolinklassifizierungsaufgabe etwas schwierig. In einigen Texten wird dies jedoch neben den verzweigen.
Eines der wichtigsten Eigenschaften des Prolins ist, dass sich in keinem Fall Wasserstoffbrücken bilden können, was es ideal macht, um Komplexe und komplizierte Kurven in den Tertiärstrukturen von Proteinen zu strukturieren.
So wie alle Aminosäuren zwei Isoformen haben, die vom zentralen Kohlenstoffatom abhängen, kann der Prolin in der Natur wie L-Prolin oder als D-Prolol gefunden werden. Form L-Prolina ist jedoch der am häufigsten vorkommende Natur und ist derjenige, der Teil der Proteinstrukturen ist.
In den Proteinen, in denen es sich befindet, nimmt das Prolin häufig Stellen in der Nähe der Oberfläche oder der Falte oder der „Drehung“ der Polypeptidkette ein, da die starre und geschlossene Struktur des Prolins eine starke Wechselwirkung mit anderen Aminosäurewechselwirkung schwierig macht.
Struktur
Das Prolin hat eine bestimmte Struktur zwischen basischen Aminosäuren, da es eine Amino -Gruppe (NH2) sekundär und nicht die primäre Aminogruppe darstellt, die für alle Aminosäuren charakteristisch ist.
Gruppe R oder die laterale Kette des Prolins ist ein Pyrrolidin- oder Tetrahydropirrol -Ring. Diese Gruppe wird durch ein heterocyclisches Amin (keine Doppelbindungen) von fünf Kohlenstoffatomen gebildet, wobei jeder mit Wasserstoffatomen gesättigt ist.
Das Prolin hat die Besonderheit, dass das "zentrale" Kohlenstoffatom in den heterocyclischen Pyrolidinring enthalten ist Die Aminosäure.
Kann Ihnen dienen: Superoxiddysmutase: Eigenschaften, Struktur, FunktionenDie molekulare Formel des Prolins lautet C5H9NO2 und ihr IUPAC-Name ist Pirrolidin-2-Carboxylsäure. Es hat ein ungefähres Molekulargewicht von 115,13 g/mol und seine Aussehensfrequenz in Proteinen liegt bei ca. 7%.
Funktionen
Kollagen und Tropocollagen -Fasern sind die am häufigsten vorkommenden Proteine bei den meisten Wirbeltieren. Diese machen Haut, Sehnen, Knochenmatrix und viele andere Gewebe aus.
Kollagenfasern bestehen aus vielen Dreifachpolypeptidauslösern, die wiederum aus mehreren Prolin- und Glycinresten in der Glycin-Praktolin-Prolin/Hydroxiprololin-Sequenz bestehen (letztere ist ein modifiziertes Derivat des Prolins).
In seiner nativen Form ist das Prolin Teil des Prokollagen. Das Enzym Prolinhydroxylase.
Was ist die Hauptfunktion des Prolins in den Kollagenfasern?
Hydroxyprolin liefert Kollagenresistenzeigenschaften, da dieses Aminosäure -Derivat die Fähigkeit hat, eine große Anzahl von Wasserstoffbrücken zwischen den dreifachen Propellerketten zu bilden, aus denen das Protein besteht.
Die Enzyme, die die Hydroxylierung von Prolinabfällen katalysieren Wasserstoffbrücken, die Kollagenfasern erhalten.
Andere Funktionen
Prolin ist für die Bildung von Falten und Proteinwendungen unverzichtbar.
Die geschlossene Struktur macht es schwierig wo es sich befindet.
Alle Proteine mit kurzer Lebensdauer haben mindestens eine Region mit reichlich wiederholten Prolin, Glutamat, Serin und Treonin. Diese Regionen gehen von 12 auf 60 Abfall und werden als Schädlingssequenzen bezeichnet.
Proteine, die die Schädlingssequenz enthalten.
Biosynthese
Viele Aminosäuren können aus Glykolyse -Vermittlern des Pentosephosphats oder des Zitronensäurzyklus (Krebszyklus) synthetisiert werden. Prolin und Arginin werden auf den kurzen Glutamatrouten gebildet.
Die praktisch häufige biosynthetische Route für alle lebenden Organismen beginnt mit der Umwandlung von L-Glutamat in γ-L-Glutamil-5-phosphat dank der Wirkung des Glutamat-5-quantlichen Enzyms (in Bakterien) oder durch γ-Glutamil- Whinas (beim Menschen).
Diese Reaktion impliziert eine ATP -abhängige Phosphorylierung, so dass zusätzlich zum Hauptprodukt ein ADP -Molekül erzeugt wird.
Die durch Glutamat 5-seemi-limid-Dehydrogenase (in Bakterien) oder durch das γ-Glutamil-Reduktase-Phosphat (im Menschen) katalysierte Reaktion konvertiert die γ-L-Glutamil-5-Phosphat CO -Faktor Nadph.
Kann Ihnen dienen: halb Stuart: Foundation, Vorbereitung und VerwendungDas L-Glutamato-5-Semialdehyd ist reversibel und spontan dehydriert auf (s) -1-1-pyrrool), in dessen Reaktion ein Molekül Nadph oder NADH ebenfalls notwendig ist.
Degradierung
Prolin, Arginin, Glutamin und Histidin werden ständig auf α-Zetoglutarat abgebaut, um in den Zyklus von Zitronensäure oder Krebszyklus einzusteigen. Im speziellen Fall des Prolins wird dies zunächst durch das Prolinoxidase-Enzym zu Pirrolin-5-carboxylat oxidiert.
Im ersten Schritt, wo die Oxidation des Prolin zu Pirrolin-5-Carboxylat auftritt, werden die abgelösten Protonen vom E-FAD akzeptiert, was auf E-FADH2 reduziert wird; Dieser Schritt ist exklusiv für Proline Aminosäure.
Aufgrund einer spontanen Reaktion wird Pirrolin-5-carboxylat in γ-Semialdehydglutamat umgewandelt, das dann als Substrat für das Enzym-Glutamat-γ-Semi-Limidische Dehydrogenase dient. In diesem Schritt entstehen zwei Protonen, einer von ihnen wird von der NAD akzeptiert, die auf NADH reduziert wird, und der andere ist frei in Form von H+.
Arginin wird wie das Prolin in γ-Semialdehyd-Glutamat umgewandelt, aber durch einen alternativen Stoffwechselweg, an dem zwei verschiedene Enzyme teilnehmen.
Die γ-Semialdehyd-Glutamat-Enzym-Dehydrogenase verwandelt Glutamat γ-Semialdehyd in L-Glutamat. Anschließend wird dieses L-Glutamat durch ein Enzymglutamat-Dehydrogenase erneut oxidiert, das schließlich das α-Zetoglutarat bildet, das in den Zitronensäurezyklus eingebaut wird.
Im Oxidationspassage von Glutamat wird ein Proton (H+) freigesetzt und eine Amino -Gruppe (NH3+). Das Proton reduziert eine NADP+ -Gruppe und ein NADPH -Molekül entsteht.
Trotz der zahlreichen Ähnlichkeiten, die zwischen dem Abbau und den Biosynthesewegen des Prolins und des Arginins bestehen, werden diese Aminosäuren synthetisiert und durch vollständig entgegengesetzte Routen abgebaut.
Lebensmittel, die reich an Valina sind
Im Allgemeinen haben alle Lebensmittel mit einem hohen Proteingehalt große Mengen an Prolin. Darunter sind Fleisch, Milch, Eier und andere. Wenn sich unser Körper jedoch in einem optimalen Zustand der Gesundheit und Ernährung befindet, kann er Prolinendogen synthetisieren.
Das Prolin kann auch in vielen Hülsenfrüchten und Nüssen und in Vollkornprodukten wie Haferflocken gefunden werden. Andere Prolin -Lebensmittel sind Weizenkleie, Nüsse, Mandeln, Erbsen, Bohnen unter anderem.
Einige Naturalist-Stores formulieren normalerweise komprimiert aus den Aminosäuren L-Lisina und L-Prololina kombiniert, um Menschen mit Gelenkproblemen zu helfen oder die Alterung von Geweben zu verzögern.
Es wurde jedoch nicht sicher gezeigt.
Vorteile Ihrer Aufnahme
Diäten, die reich an Prolin sind.
Kann Ihnen dienen: Agar m.R.S: Was ist, Foundation, Vorbereitung, verwendetViele der in der ästhetischen Industrie verwendeten pharmakologischen Lotionen und Tabletten sind mit L-Prolin angereichert, da einige Studien gezeigt haben, dass diese Aminosäure irgendwie die Kollagensynthese erhöhen und daher die Textur der Haut verbessert, die Heilung von Wunden beschleunigt, beschleunigt Verletzungen, Geschwüre und Verbrennungen.
In der Lebensmittelindustrie gibt es Proteine mit „bioaktiven Peptiden“, die Funktionen über ihre Ernährungseigenschaften hinaus ausüben. Diese Peptide haben im Allgemeinen zwei bis neun Aminosäureabfälle, unter denen Prolin, Arginin und Lysin im Überfluss vorhanden sind.
Diese bioaktiven Peptide können eine blutdrucksenkende Aktivität mit einer bestimmten Opioidwirkung haben. Sie können als Immunmodulatoren fungieren, indem sie die Immunantwort gegen einige Krankheitserreger stimulieren und sogar eine Erhöhung der Vasoaktivität verursachen, was die Zirkulation derjenigen verbessert, die sie konsumieren.
Mangelerkrankungen
Gluten ist ein Protein, das in den Weizenkörnern vorhanden ist, die Darmentzündungen verursachen. Menschen, die an "Gluten -Intoleranz" leiden.
Einige Krankheiten haben mit der schlechten Faltung wichtiger Proteine zu tun, und es ist sehr häufig, dass diese Defekte mit Isomerisierung zu tun haben Cis-trans von Amida -Verbindungen in Prolinabfällen, da im Gegensatz zu anderen Peptidverbindungen das Isomer trans Es ist sehr bevorzugt, im Prolin ist es benachteiligt.
Bei Prolinabfällen wurde beobachtet, dass es eine signifikante Tendenz zur Bildung des Isomers gibt Cis zuerst als der Isomer trans In den angrenzenden Amiden zu Prolinabfällen, die eine "falsche" Konformation von Proteinen erzeugen können.
Stoffwechselstörungen
Wie bei anderen wesentlichen und nicht essentialen Aminosäuren müssen die mit dem Prolin im Zusammenhang mit dem Prolin in Bezug auf die Assimilationsrouten dieser Aminosäure zuständigen Hauptstörungen normalerweise tun.
Hyperprolinämie ist beispielsweise ein typischer Fall von Mangel in einem der Enzyme, die am Prolinabbauweg beteiligt sind, insbesondere in der 1-Pyrolin-5-Carboxylat-Dehydrogenase, die zu einer Akkumulation sein.
Diese Pathologie wird normalerweise durch hohen Prolingehalte im Blutplasma und durch das Vorhandensein des 1-Pyrrololin-5-Carboxylat-Metaboliten im Urin betroffener Patienten diagnostiziert.
Die Hauptsymptome dieser Krankheit bestehen aus neurologischen Störungen, Nierenerkrankungen und Verlust von Hörkapazität oder Taubheit. Andere schwerwiegendere Fälle sind schwerwiegende mentale Verzögerungen und ausgeprägte psychomotorische Schwierigkeiten.
Verweise
- Abu-Baker, s. (2015). Überprüfung der Biochemie: Konzepte und Verbindungen
- Delauney, a. J., & Verma, D. P. S. (1993). Prolinbiosynthese und Osmoregulation in Pflanzen. Das Plant Journal, 4 (2), 215-223.
- Liste, b., Lerner, r. ZU., & Barbas, C. F. (2000). Prolinkatalysierte direkte asymmetrische Aldol-Reaktionen. Journal of the American Chemical Society, 122 (10), 2395-2396
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Plimmer, r. H. ZU. (1912). Die chemische Konstitution der Proteine (vol. 1). Longmans, grün.
- Szabados, l., & Savouré, zu. (2010). Prolin: eine multifunktionale Aminosäure. Trends in der Pflanzenwissenschaft, 15 (2), 89-97.
- « Tachtenberg -Methode Was ist, Beispiele, Beispiele
- Typtophaneigenschaften, Struktur, Funktionen, Vorteile »

