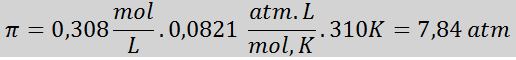Koligative Eigenschaften von Lösungen
- 4689
- 821
- Nick Laurén
Was sind koligative Eigenschaften?
Der Kolligative Eigenschaften, Auch als kollektive Eigenschaften von Lösungen bezeichnet, sind sie eine Gruppe von vier Eigenschaften, die ausschließlich von der Menge der in der Lösung vorhandenen Partikel abhängen, jedoch nicht von der Art dieser Partikel.
Mit anderen Worten, diese Eigenschaften ergeben sich aus dem Vorhandensein anderer Partikel als dem Lösungsmittel, dh Partikel des gelösten Stoffes, hängen jedoch nicht davon ab, wer der gelöste Stoff ist. Jede Art von Teilchen kann koligative Eigenschaften führen, egal ob es Atome, Ionen oder Moleküle sind. Das einzige, was zählt, ist Ihre Konzentration.
Die koligativen Eigenschaften sind vier:
- Entscheidung über den Dampfdruck des Lösungsmittels
- Ebulllocopic Elevation
- Kritischer Abstammung
- Osmotischer Druck
Alle sind durch proportionaler Konzentration des gelösten Stoffes bei relativ verdünnten Lösungen (Konzentration <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Sehen wir uns jede dieser vier Eigenschaften im Detail an:
1. Entscheidung über den Dampfdruck des Lösungsmittels
Wenn eine nicht -volatile gelöste Lösung hergestellt wird, ist der Dampfdruck der resultierenden Lösung immer geringer als der Dampfdruck des reinen Lösungsmittels. Mit anderen Worten, auflösen Sie einen nichtflüchtigen gelösten Stoff in einem Lösungsmittel, verursachen eine Abnahme des Dampfdrucks des Lösungsmittels im Vergleich zum reinen Lösungsmittel.
Formel des Dampfdrucks abnimmt
Wie alle koligativen Eigenschaften ist die Abnahme des Dampfdrucks (DP) proportional zur Konzentration des gelösten Stoffes. Kombiniert das Raault -Gesetz mit den Molfraktionsgleichungen und kann nachgewiesen werden, dass DP gegeben wird durch:
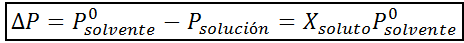
wo p °Lösungsmittel repräsentiert den Dampfdruck des reinen Lösungsmittels bei einer bestimmten Temperatur, pLösung entspricht dem Dampfdruck der Lösung und xgelöst repräsentiert die Konzentration des als molaren Fraktion ausgedrückten gelösten gelösten Stoff.
Warum verringert sich der Dampfdruck mit dem gelösten Stoff??
Die Kraft, die die meisten natürlichen Prozesse wie die Verdunstung eines Lösungsmittels antreibt, ist die Zunahme der Entropie oder des Störungsniveaus. Wenn eine Flüssigkeit verdunstet, geht sie von einem sehr ordentlichen Zustand (in der Flüssigkeit) zu einem sehr chaotischen (in Gas), da es in der Gasphase viel mehr Bewegungsfreiheit gibt.
Kann Ihnen dienen: violettes GlasIn einer Lösung fügt das Vorhandensein des gelösten Stoffes der flüssigen Phase jedoch eine Störung hinzu, während sie die Gasphase nicht beeinflusst (da der gelöste gelöste nicht verdunstet).
Aus diesem Grund liegt der Unterschied im Störungsniveau zwischen der Lösung und der Gasphase unter dem reinen Lösungsmittel und der Gasphase unter.
Beispiel
Problem: Da der Wasserdampfdruck bei einer bestimmten Temperatur 30,55 mmHg beträgt, bestimmen Sie den Dampfdruck einer vorbereiteten Lösung, die 7,20 Gramm Glukose (Molmasse oder mm = 180 g/mol) in 360 g Wasser (mm = 18,0 g/mol) auflöst. bei der gleichen Temperatur.
Lösung: In diesem Fall muss zuerst der Molfraktion des gelösten Stoffes berechnet werden. Wir haben bereits alle notwendigen Daten dafür:
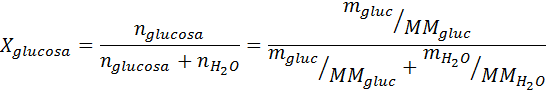
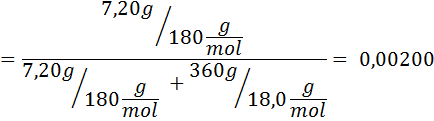
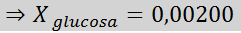
Dann wird die Gleichung der Dampfdruckabnahme angewendet.
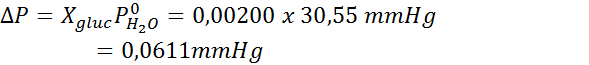
Jetzt bestimmen wir den neuen Dampfdruck des Lösungsmittels:
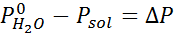
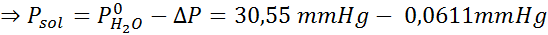
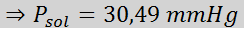
2. Ebulllocopic -Erhöhung oder Siedepunkt
Ebulllocopic Elevation bezieht sich auf den Anstieg des Siedepunkts einer Lösung im Vergleich zum Siedepunkt des reinen Lösungsmittels. Um zu verstehen, warum dies geschieht, denken Sie daran, dass der Siedepunkt als die Temperatur definiert ist, bei der der Dampfdruck einer Flüssigkeit gleich dem atmosphärischen Druck erfolgt.
Da die Lösungen einen geringeren Dampfdruck als das reine Lösungsmittel haben (wie wir gerade im vorherigen Abschnitt gesehen haben), müssen er mehr erwärmt werden, um den atmosphärischen Druck zu erreichen und so ihren Siedepunkt zu erreichen. Aus diesem Grund ist der Siedepunkt der Lösungen (mit nichtflüchtigen Stoffen) immer größer als der des reinen Lösungsmittels.
Ebulllocopic Elevation Formel
Die Zunahme des Siedepunkts (DTB) Es ist proportional zur Konzentration des in Molealität exprimierten gelösten gelösten gelösten Stoffe, wie durch die folgende Gleichung angezeigt:
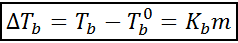
Wo tB Es ist der Siedepunkt der Lösung, tB° Es ist der Siedepunkt von reinem Lösungsmittel, KB Es ist die eBullloskopische Konstante des Lösungsmittels und M Es ist die Malealität des gelösten Stoffes.
Beispiel
Problem: Zu wissen, dass die Kochenkonstante des Wassers 0,52 ° C beträgt.kg/mol, bestimmen Sie den Siedepunkt der im vorherigen Beispiel hergestellten Glukoselösung.
Lösung: Um die EbullLoscopic -Erhöhung zu bestimmen, brauchen wir nur Moral.
Kann Ihnen dienen: Zinnoxid (II): Struktur, Eigenschaften, Nomenklatur, verwendet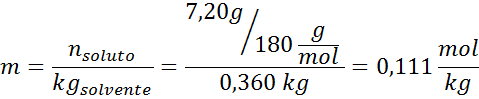
Jetzt wenden wir die DT -Formel anB:
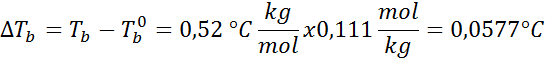
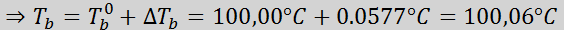
3. Kritischer Abstammung
Die kryoskopische Abnahme ist die Abnahme des Gefrierpunkts einer Lösung im Vergleich zum Gefrierpunkt des reinen Lösungsmittels. Der Grund, warum dies geschieht.
Diese Eigenschaft wird bei kaltem Wetter weit verbreitet, wo sie im Winter schneit. In diesen Ländern ist es sehr häufig zu sehen2 auf Straßen oder auf öffentlichen Bänken, worauf der Schnee schmilzt. Der Grund, warum es schmilzt, ist, dass Salz den Gefrierpunkt des Wassers verringert.
Crioscopic -Abstammungsformel
Die chrioskopische Abstiegsgleichung ist der des Ebulllocopic -Anstiegs sehr ähnlich. Es ist auch proportional zur moralischen Konzentration und hängt in diesem Fall von einer kryoskopischen Konstante des Lösungsmittels ab.
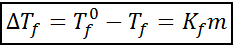
wo tF Es ist der Gefrierpunkt der Lösung, tF° Es ist der Gefrierpunkt des reinen Lösungsmittels, KF Es ist die chrioskopische Konstante des Lösungsmittels und M Es ist die Malealität des gelösten Stoffes.
Beispiel
Problem: Zu wissen, dass die kryoskopische Wasserkonstante 1,86 ° C beträgt.kg/mol, bestimmen Sie den Gefrierpunkt der im vorherigen Beispiel hergestellten Glukoselösung.
Lösung: Die Moral der Lösung wurde bereits bestimmt, sodass wir DT direkt bestimmen könnenF Verwenden der vorherigen Formel:
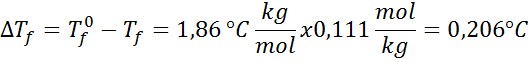
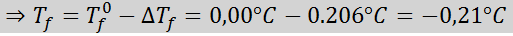
4. Osmotischer Druck
Osmose ist ein Prozess von großer Bedeutung auf chemischer und biologischer Ebene. Dies besteht aus dem Fluss von Lösungsmittelmolekülen (z. B. Wasser) von einer verdünnten Lösung zu einer anderen konzentrierten Lösung, wenn sie mittels einer semipermeablen Membran getrennt werden (die das Lösungsmittel nur noch passieren lässt, aber nicht den gelösten Stoff).
Diese Tendenz, das Lösungsmittel durch eine semipermazierbare Membran zu "absorbieren", ist eine Eigenschaft, die ausschließlich von der Gesamtkonzentration von in der Lösung vorhanden. Aus diesem Grund ist dieser Trend eine koligative Eigenschaft und wird durch osmotischen Druck gemessen.
Osmotischer Druck (π) ist der Druck, der auf eine Lösung angewendet werden sollte, um die Osmose zu stoppen. Je größer der osmotische Druck ist, desto mehr Tendenz hat die Lösung, um Lösungsmittel zu absorbieren (oder genauer gesagt, desto mehr Trend des Lösungsmittels zur Ausbreitung dieser Lösung) die Lösung).
Kann Ihnen dienen: Magnesium: Geschichte, Struktur, Eigenschaften, Reaktionen, verwendetWarum tritt Osmose auf?
Die Erklärung hinter dem Osmoseprozess ist sehr einfach. Alle Substanzen neigen dazu, sich aus der Stelle auszubreiten, an der sie sich mehr befinden, wo sie verdünnter sind. Dies soll Ihrem Konzentrationsgradienten folgen.
Wenn eine Lösung stärker auf gelösten Stoff konzentriert ist, ist sie gleichzeitig in Lösungsmittel verwässert und umgekehrt. Aus diesem Grund hat das Lösungsmittel die natürliche Tendenz, von der am meisten verdünnten Lösung (wo das Lösungsmittel konzentrierter ist) in Richtung der konzentrierten Lösung (wo es verdünnter ist) zu gehen (wo es verdünnter ist).
Osmotische Druckformel
Osmotischer Druck kann mit einer Formel berechnet werden, die der Gleichung idealer Gase sehr ähnlich ist:
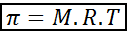
In dieser Gleichung ist π der osmotische Druck, M ist die molare Konzentration des gelösten Stoffes, R ist die universelle Konstante der idealen Gase (0,0821 atm.L/mol.K) und t ist die absolute Temperatur in k.
Osmotischer Druck und Tonizität
Osmotischer Druck ist sehr wichtig für die Funktion des menschlichen Körpers. Tatsächlich werden die intravenös injizierten Salzlösungen nach dem, ob ihr osmotischer Druck größer oder weniger als das des Blutplasmas zu der sogenannten Tonizität ist, klassifiziert.
- Eine weniger konzentrierte Lösung, die Plasma einen niedrigeren osmotischen Druck hat und erzählt wird Hypotonische Lösung.
- Wenn Sie die gleiche Gesamtkonzentration von gelösten Stoffen haben, wird dies mitgeteilt isotonische Lösung.
- Wenn Sie einen größeren osmotischen (oder Konzentrations-) Druck haben, wird dies gesagt hypertonische Lösung.
Beispiel
Problem: Berechnen Sie den osmotischen Druck bei 310 K einer 0,9% igen Salzlösung (m/V), die mit Blutplasma isotonisch ist.
Lösung: Wir haben bereits die Temperatur. Das einzige, was fehlt, ist die Bestimmung der molaren Konzentration der Salzpartikel (NaCl) in der Lösung. Dafür.
Alle 100 ml Lösung enthält 0,9 g NaCl, also:
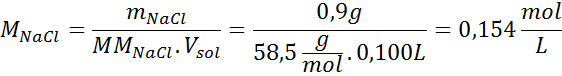
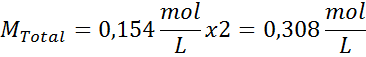
Dies ist die Gesamtkonzentration von Partikeln gelöster Stoff -Partikel in der Lösung, sodass wir jetzt den osmotischen Druck berechnen können: