Physikalische und chemische Eigenschaften von Wasser

- 3208
- 555
- Jasmine Kupprion
Der physikalische und chemische Eigenschaften von Wasser Sie sind all diese Manifestationen des Wassers, die wir dank der Wechselwirkungen ihrer Moleküle mit sich selbst oder ihrer Umgebung messen können. Aber was ist Wasser?? Wasser ist eine chemische Substanz oder Molekül, die durch die Vereinigung eines Sauerstoffatoms (O) mit zwei Wasserstoffatomen (H) gebildet wird.
Diese drei Atome bleiben durch die Bildung kovalenter Bindungen, sehr starke und stabile Verbindungen vereint. Das Wassermolekül ist für die Formel H2Oder als h-o-h schreiben können. Es ist dieses Molekül, seine Verbindungen und seine Wechselwirkungen sind dafür verantwortlich, eine farblose und geschmacklose flüssige Substanz zu sein.

Wasser befindet sich in einem großen verteilten Verhältnis auf der Erde zwischen frischem und gesalzenem Wasser. Wasser ist unverzichtbar, damit das Leben auf unserem Planeten existiert, da es eine sehr wertvolle natürliche Ressource ist. Es ist zwischen 60 und 70% in lebenden Organismen, was ein hoher Anteil ist, der es ihnen ermöglicht, unzählige Funktionen zu erfüllen.
Zu einigen dieser wichtigen Funktionen gehören strukturelle Regulatoren wie Körpertemperaturbehörden und pH -Regulierung (Säure oder Alkalität) innerhalb der normalen Grenzen. Ebenso führt Wasser den Transport von Nährstoffen und Abfällen in Lebewesen durch.
Es wird auch in vielen Bereichen der produktiven, technologischen, wissenschaftlichen und täglichen Routinearbeit des Menschen verwendet. Aus der Toilette, Lebensmittelkochen unter anderem.
[TOC]
Physische Wassereigenschaften
Die physikalischen Eigenschaften von Wasser hängen mit den Merkmalen oder Größen zusammen, die unter anderem gemessen oder bestimmt werden können, wenn sie Materie berücksichtigen, z. B. ihre Masse und Energie.
Zu den physikalischen Größen von Wasser gehören seine Farbe, der Geruch, die Art und Weise, wie es gefunden werden kann, und all diejenigen, die wir ohne Reaktionen bestimmen oder ihre chemische Zusammensetzung verändern können.
Schmecken
Indem wir unserem Gaumen etwas reines Wasser probieren, stellt sich heraus, dass es Insabor oder aromatisch ist. Es ist ebenso geruchlos oder riecht. Für den Reinigungsprozess kann ein leichter Geruch wahrgenommen werden, der auf Chlorreste zurückzuführen ist. Es sind die Mineralien, die dem Wasser verschiedene Aromenbuchstaben gewähren.
Aspekt

Wasser im Allgemeinen ist farblos und transparent, wenn es in einem Glas beobachtet wird. Es scheint jedoch, dass es eine hellblaue Farbe hatte, wenn es in großen Behältern in großen Mengen angesammelt oder in Gletschern, Flüssen oder Meeren beobachtet wurde.
Kann Ihnen dienen: Was sind Forschungsquellen??Und in der Tat weist das Wasser eine gewisse bläuliche, bläuliche Färbung auf, deren Wahrnehmung konzentriert ist, je höher die Menge an Wasser.
Wasserstaaten
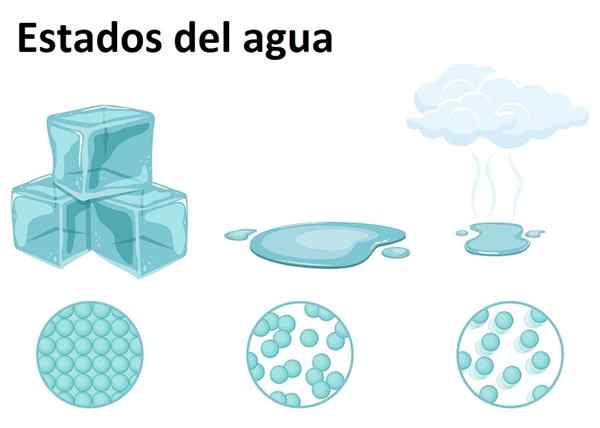 Fester, flüssiger und gasförmiger Zustand
Fester, flüssiger und gasförmiger Zustand Wasser ist auf der Erde sehr reichlich vorhanden und kann in einem der drei Materiezustände gefunden werden: fest, flüssig oder gasförmig. Wasser bei Raumtemperatur ist eine flüssige Substanz, die seiner häufigsten Form entspricht.
Wasser wird je nach Größe seiner Kristalle und dem Prozess seiner Bildung Eis oder Schnee genannt. In der Zwischenzeit bildet sich der gasförmige Zustand, wenn das Wasser vom flüssigen Zustand zum Gas übergeht und den berühmten Wasserdampf bildet, der in der Küche und über Lebensmitteln leicht erkennbar ist.
Dichte
Reine Wasserdichtebereiche rund 1 g/cm3. In der Zwischenzeit ist die Dichte des Meerwassers aufgrund des Salzes, das sie enthält.
Gefrierpunkt
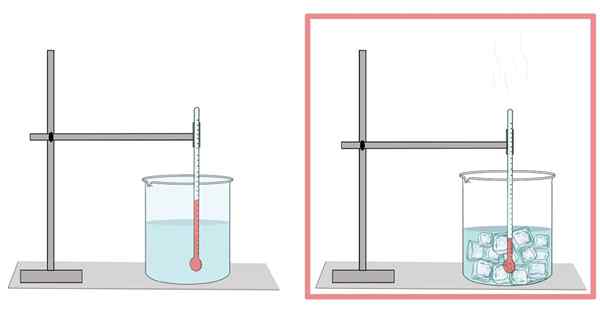
Wasser friert bei 0 ° C ein. Bei dieser Temperatur verläuft von seiner flüssigen Phase zum Feststoff. Wenn das Wasser eingefroren ist, dehnt es sich aus. Deshalb hat es in seiner festen Form weniger Dichte als in seinem flüssigen Zustand, was es für Eis leichter macht, auf flüssigem Wasser zu schweben.
Ebenso ist dies der Grund, warum die Wasserkühlung in einer Flasche nicht viel gefüllt werden sollte, da sich das Eis ausdehnt und die Flasche brechen.
Siedepunkt
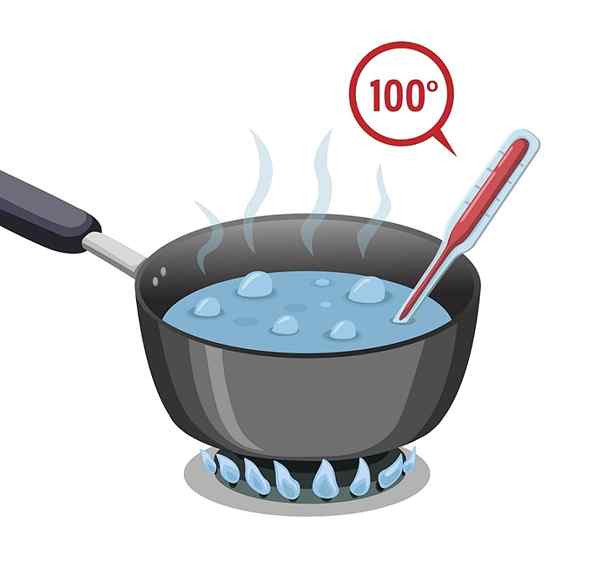
Das Wasser hat einen hohen Siedepunkt, der 100 ° C beträgt. Es muss heiß ausgesetzt sein, damit es heizen und kochen oder seinen Siedepunkt erreichen kann.
Das Wasser hat dann eine hohe spezifische Wärme oder auch als Wärmekapazität bezeichnet, wodurch die Erwärmung verzögert wird. Aber auch abzukühlen, der Prozess, der erforderlich ist, um die erworbene Wärme zu verlieren.
Diese Eigenschaft macht es sehr nützlich in Kühlsystemen, in Körpertemperaturregulationssystemen, unter anderem im Zusammenhang.
Elektrische Leitfähigkeit
Wasser ist ein guter Stromleiter. So rein, dass das Wasser immer eine gewisse Menge an Ionen hat, was ihm die Eigenschaft gibt, einen der höchsten dielektrischen Konstanten unter nicht -metallischen Flüssigkeiten zu haben.
Zusammenhalt
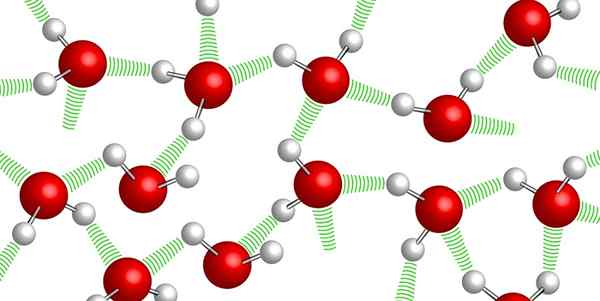 Wasserstoffbrücken zwischen Wassermolekülen
Wasserstoffbrücken zwischen Wassermolekülen Wassermoleküle bleiben dank der sogenannten Wasserstoffbrücken zusammen miteinander: Schwache Bindungen, die zwischen einem und einem anderen Wassermolekül hergestellt werden. Aufgrund dieses hohen Zusammenhaltsgrads ist es sehr schwierig, Wasser zu komprimieren.
Kann Ihnen dienen: 7 DokumentarfilmforschungsinstrumenteBeitritt

Es ist leicht, dass Wasser beispielsweise an der gut sauberen Oberfläche eines Glass haftet und einen Film bildet, den wir Feuchtigkeit oder "nass" nennen, oder "nass". Außerdem haftet Wasser schnell an unserer Haut, so dass wir nass werden, sobald wir in einen Pool kommen. Andernfalls würden wir in Sekunden trocknen.
Oberflächenspannung
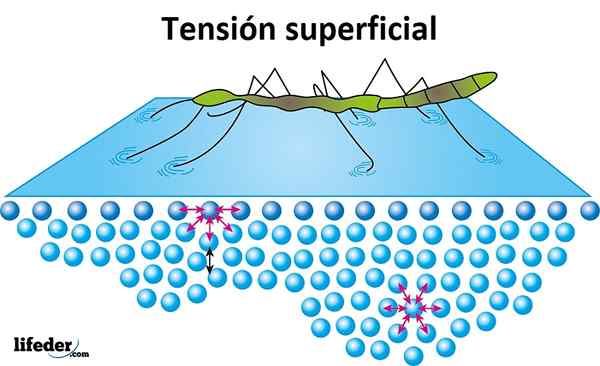
Die Oberflächenspannung ist der Widerstand, den die Flüssigkeit auf ihrer Oberfläche durchdringen soll. Wasser hat eine hohe Oberflächenspannung, ein Produkt des Zusammenhalts, der zwischen seinen Molekülen besteht.
Die Oberflächenspannung zeigt.
Kapillarität

Die Leichtigkeit, mit der das Wasser steigt oder durch ein Kapillarrohr niedrig ist, beschreibt die Kapillaritätseigenschaft des Wassers. Diese Eigenschaft ist auch auf die hohen Eigenschaften von Kohäsion und Adhäsion zurückzuführen, die Wasser hat.
Die Kapillarität wird von der Pflanzen Natur ausgenutzt, um den Blättern der höchsten Äste eines Baumes Wasser zu liefern, und erleichtert seine Absorption durch die Wurzeln der Pflanzen.
Ebenso machen die Eigenschaften von Oberflächenspannung und Kapillarität das Wasser zu einem strukturellen Teil der Zellen, der Teil des Blutes ist und der leicht durch die verschiedenen Blutgefäße fließt oder fließt.
Lösungsmittelaktion

Wasser kann viele Substanzen auflösen, die für lebende Organismen von entscheidender Bedeutung sind, da alle chemischen Reaktionen von Lebewesen in einer wässrigen Umgebung auftreten. In lebenden Organismen dient es als Transport von Nährstoffen, Ionen und vielen anderen Substanzen.
Es dient auch für den Transport von Abfällen wie Harnstoff, der in Urinwasser beseitigt wird. Wenn sich eine Substanz auflöst und sich gut mit Wasser mischt. Wenn Sie sich nicht gut mischen oder auflösen, wird gesagt, dass die Substanz im Wasser hydrophobe oder unlöslich ist.
Chemische Wassereigenschaften
Chemische Eigenschaften oder Eigenschaften sind solche, die auftreten, wenn Änderungen der chemischen Struktur von Wasser erzeugt werden. Es ist wichtig, dann einen kurzen Blick auf seine molekulare Struktur zu werfen.
Chemischer Natur
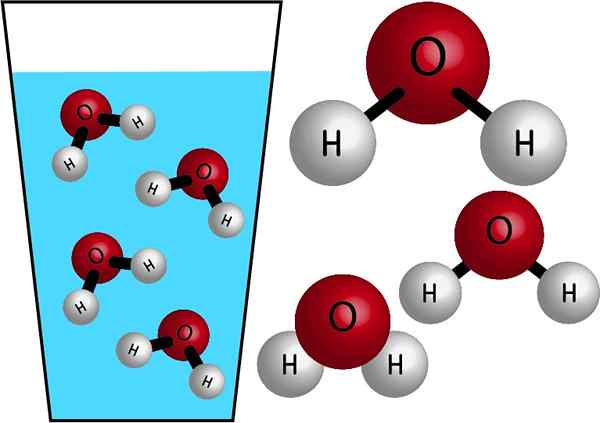
Wasser ist ein anorganisches Molekül, da es kein C (Kohlenstoff) enthält, und seine chemische Formel ist H2ENTWEDER. Ihre Atom. Seine Molmasse beträgt 18 g/mol, dh ein Wassermol Wasser hat eine Masse von 18 Gramm.
Kann Ihnen dienen: wissenschaftliche ForschungPolarität
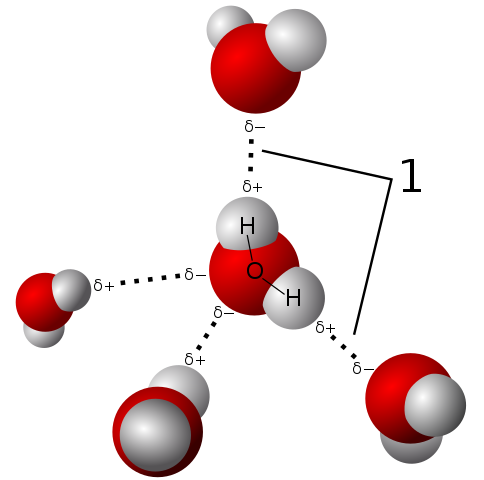 Die Wasserpolarität ermöglicht es seinem Molekül, sehr starke Wasserstoffbrücken zu etablieren
Die Wasserpolarität ermöglicht es seinem Molekül, sehr starke Wasserstoffbrücken zu etablieren Das Wassermolekül ist neutral, bietet aber eine gewisse Polarität, da das Teilen seiner Elektronen nicht so gerecht ist.
Da Sauerstoff die gemeinsamen Elektronen für sich selbst stärker anzieht, besteht das Wassermolekül mit dieser Seite, auf der Sauerstoff eine negative Belastung aufweist. Und deshalb bleibt es eine positive Teilbelastung, bei der die Hydrogene sind (beobachten Sie das überlegene Bild).
Diese Polarität erleichtert die Vereinigung miteinander der Wassermoleküle und der Wasservereinigung mit anderen Molekülen, die auch Lastunterschiede in ihrer Struktur aufweisen, was die in den vorherigen Abschnitten beschriebenen physikalischen Eigenschaften fördert.
Ionisation
Spontan im flüssigen Wasser gibt es eine leichte Ionisation oder Selbstdissoziation. Dies bedeutet, dass einige seiner Moleküle neu organisiert werden, indem seine normale molekulare Struktur verändert wird, die neue elektrisch beladene Moleküle wie Hydroniumionen erzeugt (H)3ENTWEDER+) und Hydroxyl (OH-).
Reaktivkapazität
Wasser reagiert mit vielen Substanzen und bildet eine große Vielfalt chemischer Verbindungen. Durch die Elektrolyse kann Wasser durch Trennen von Sauerstoff von seinen beiden Hydrogenen gebrochen werden. Dieser Vorgang tritt auf, wenn ein elektrischer Strom durch Wasser führt. Sogar Wasser in seiner festen Form kann auch Teil einiger chemischer Reaktionen sein.
pH
 pH fast 7
pH fast 7 Reines Wasser hat einen neutralen pH -Wert (gleich 7), während das Meerwasser leicht alkalisch ist (mehr als 7). Regenwasser wird bei gemischt mit den in der Atmosphäre gefundenen Komponenten angesäuert (pH weniger als 7), wie Kohlendioxid oder Co2, Zum Beispiel.
Anfoterismus
Wasser ist amphotat, dh es kann sich je nach pH -Wert der Lösung wie eine Säure oder als Basis verhalten. Diese chemische Eigenschaft unterstützt seine Rolle als PH -Regulator.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Castillero m. ENTWEDER. (2020). Psychologie und Verstand. Die 15 physikalischen und chemischen Eigenschaften von Wasser. Erholt von: Psychologie und.com
- Wikipedia (2020). Eigenschaften von Wasser. Abgerufen von: in.Wikipedia.Org
- Scharf k. ZU. (S.F.). Wasser: Struktur und Eigenschaften. Erholt von: Kristall.Med.Upenn.Edu
- Byju. (S.F.). Physikalische und chemische Eigenschaften von Wasser. Erholt von: Byjus.com
- Schulergie und Umwelt. (S.F.). Wasser war eine Ressource. Erholt von: eariscuola.Netz
- « Glycocálix -Funktionen, die es erfüllt, und Komponenten
- Kontabalgationskonzept, Typen, Eigenschaften »

