Regelmäßige Eigenschaften der Elemente und ihrer Merkmale

- 1156
- 299
- Joe Hartwig
Der Periodische Eigenschaften der Elemente Sie sind diejenigen, die ihr physikalisches und chemisches Verhalten aus atomarer Perspektive definieren und deren Größen zusätzlich zur Atomzahl eine Klassifizierung von Atomen ermöglichen.
Von allen Eigenschaften sind diese, wie der Name schon sagt, charakterisiert, weil sie regelmäßig sind; Das heißt, wenn die Periodenzüchter untersucht wird, kann zertifiziert werden, dass ihre Größen einem Trend gehorchen, der mit der Bestellung der Elemente in Perioden (Zeilen) und Gruppen (Spalten) zusammenfällt und wiederholt.
 Intrinsische Periodizität eines Teils der Elemente der Periodenzüchtertabelle. Quelle: Gabriel Bolívar.
Intrinsische Periodizität eines Teils der Elemente der Periodenzüchtertabelle. Quelle: Gabriel Bolívar. Wenn Sie beispielsweise eine periodische Periode reisen und die Eigenschaft mit der Größe mit jedem Element abnimmt, tritt dies in allen Zeiträumen auf. Auf der anderen Seite, wenn sie eine Gruppe oder Säule hinuntergeht, erhöht sie ihre Größe, dies ist für die anderen Gruppen auch zu erwarten.
Und daher werden ihre Variationen wiederholt und belegt einen einfachen Trend, der mit der Bestellung der Elemente für ihre Atomzahlen übereinstimmt. Diese Eigenschaften sind direkt für die metallische oder nicht metallische Natur der Elemente sowie für ihre Reaktivitäten verantwortlich, die dazu beigetragen haben, sie mit größerer Tiefe zu klassifizieren.
Wenn die Identität der Elemente für einen Moment unbekannt war und sie als seltsame "Kugeln" angesehen wurden, konnte der Periodenzüchter (mit viel Arbeit) (mit viel Arbeit) diese Eigenschaften nutzen.
Auf diese Weise würden die vermeintlichen Kugeln Farben erwerben, die es ihnen ermöglichen würden, sie in Gruppen voneinander zu unterscheiden (überlegenes Bild). Wenn sie ihre elektronischen Eigenschaften kennen, könnten sie sich in Zeiträumen organisieren, und die Gruppen würden diejenigen verraten, die die gleiche Anzahl von Valenzelektronen haben.
Das Lernen und Argumentieren regelmäßige Eigenschaften sind gleich zu wissen, warum die Elemente auf die eine oder andere Weise reagieren. Es ist zu wissen, warum sich die Metallelemente in bestimmten Regionen der Tabelle und die nicht -metallischen Elemente in einem anderen befinden.
[TOC]
Was sind die periodischen Eigenschaften und ihre Eigenschaften?
-Atomradio
Wenn das Bild beobachtet wird, ist das erste, was bemerkt werden kann, dass nicht alle die gleiche Größe haben. Einige sind sperriger als andere. Wenn sie mit genaueren Details beobachtet werden, wird festgestellt, dass diese Größen ein Muster befolgen: In einer Zeit nimmt sie von links nach rechts ab und steigt in einer Gruppe von oben nach unten an.
Auf diese Weise kann auch das oben genannte gesagt werden: Der Atomradius nimmt gegenüber den Gruppen oder Säulen der rechten Seite ab und erhöht sich in den unteren Perioden oder Zeilen. Somit ist der Atomradius die erste periodische Eigenschaft, da seine Variationen einem Muster innerhalb der Elemente folgen.
Kernlast gegen Elektronen
Was ist dieses Muster? In einem Zeitraum belegen die Atomelektronen das gleiche Energieniveau, was mit der Entfernung zusammenhängt, die sie vom Kern trennt. Wenn wir von einer Gruppe zu einer anderen wechseln (was dem Zeitraum nach rechts ist), fügt der Kern sowohl Elektronen als auch Protonen innerhalb desselben Energieniveaus hinzu.
Kann Ihnen dienen: KohlenstoffDaher können Elektronen keine Entfernungen weiter vom Kern entfernt, was seine positive Belastung erhöht, da sie mehr Protonen hat. Infolgedessen erleben Elektronen eine größere Anziehungskraft gegenüber dem Kern und ziehen sie immer mehr an, wenn die Anzahl der Protonen zunimmt.
Deshalb haben die Elemente am rechten Ende des Periodenzüchtertabels (gelbe und türkisfarbene Säulen) kleinere Atomradios.
Auf der anderen Seite, wenn "Sprünge" von einer Periode zu einer anderen (was zu sagen ist, dass eine Gruppe abstammt), ermöglichen die neuen aktivierten Energieniveaus Elektronen, weitere entfernte Räume im Kern zu besetzen. Da der Kern (mit mehr Protonen) sie weiter mit weniger Kraft zieht; Und atomare Radios nehmen daher zu.
Ionische Funkgeräte
Ionische Radios gehorchen einem Muster, das dem von atomaren Radios ähnelt; Diese hängen jedoch nicht so sehr vom Kern ab, aber wie viele Elektronen oder weniger hat das Atom in Bezug auf seinen neutralen Zustand.
Kationen (Na+, AC2+, Zum3+, Sei2+, Glaube3+) eine positive Belastung aufweisen, weil sie ein oder mehrere Elektronen verloren haben, und daher zieht der Kern sie mit größerer Kraft an. Das Ergebnis: Kationen sind kleiner als die Atome, von denen sie ableiten.
Und für Anionen (oder2-, F-, S2-, Yo-) Im Gegenteil weisen sie negative Belastungen auf. Das Ergebnis: Die Anionen sind größer als die Atome, aus denen sie abgeleitet sind (unteres Bild).
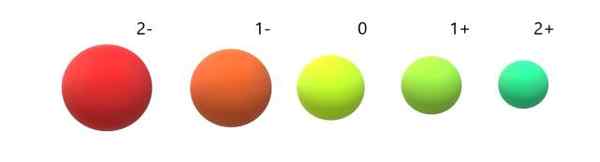 Variation von ionischen Radios in Bezug auf das neutrale Atom. Quelle: Gabriel Bolívar.
Variation von ionischen Radios in Bezug auf das neutrale Atom. Quelle: Gabriel Bolívar. Es ist ersichtlich, dass Anion 2- am voluminosensten von allen ist und das Kation 2+ das kleinste. Radios erhöhen sich, wenn das Atom negativ aufgeladen ist und sich zusammenzieht, wenn es positiv geladen wird.
-Elektronegativität
Wenn die Elemente kleine atomare Radios haben, werden nicht nur ihre Elektronen stark angezogen, sondern auch die Elektronen benachbarter Atome, wenn sie eine chemische Bindung bilden. Diese Tendenz, die Elektronen anderer Atome innerhalb einer Verbindung anzuziehen, ist das, was als Elektronegativität bezeichnet wird.
Das, das ein Atom klein ist, bedeutet nicht, dass es elektronegativer sein wird. In diesem Fall wären Helium- und Wasserstoffelemente die elektronegativsten Atome. Helium, wo die Wissenschaft gezeigt hat, bildet keine kovalente Verbindung jeglicher Art; Und Wasserstoff hat kaum ein einzelnes Proton im Kern.
Kann Ihnen dienen: Kupfersulfid: Struktur, Eigenschaften, verwendetWenn Atomradios groß sind, haben die Kerne nicht genug Kraft, um die Elektronen anderer Atome anzuziehen. Daher sind die elektronegativsten Elemente diejenigen mit einem kleinen Atomradius und einer größeren Anzahl von Protonen.
Wiederum sind diejenigen, die diese Eigenschaften perfekt erfüllen, die nicht -metallischen Elemente des P -Blocks des Periodenzüchtertabels; Dies sind diejenigen, die zu Gruppe 16 oder Sauerstoff (O, S, SE, TE, PO) und Gruppe 17 oder Fluor (F, Cl, Br, I, AT) gehören.
Trend
Nach allem, was gesagt wurde, befinden sich die elektronegativsten Elemente besonders in der oberen rechten Ecke des Periodenzüchtertabellen. Fluorid als Element haben, das die Liste der elektronegativsten führt.
Weil? Ohne auf Elektronegativitätsskalen zurückzugreifen (Pauling, Mulliken, usw.), der Fluor, obwohl er größer ist als das Neon (das edle Gas seiner Periode), der erste kann Links bilden, während der zweite nicht der Fall ist. Darüber hinaus gibt es für seine geringe Größe sein Kern viele Protonen, und wo der Fluor ist, wird es ein Dipolmoment geben.
-Metallischer Charakter
Wenn ein Element im Vergleich zu denen des gleichen Zeitraums einen Atomradius hat und auch wenig elektronegativ ist, ist es dann ein Metall und hat einen hohen metallischen Charakter.
Wenn wir zum Hauptbild zurückkehren, entsprechen die rötlichen und grünlichen Kugeln, ebenso wie das Grau, Metallelementen. Metalle haben einzigartige Eigenschaften, und von hier aus werden die regelmäßigen Eigenschaften mit den physikalischen und makroskopischen Eigenschaften der Materie miteinander verflochten.
Die Elemente mit einem hohen metallischen Charakter sind durch ihre relativ großen Atome gekennzeichnet, leicht zu verlierenelektronen, da die Kerne sie kaum zu ihnen anziehen können.
Infolgedessen oxidieren oder verlieren sie Elektronen leicht, um Kationen zu bilden, m+; Dies bedeutet nicht, dass alle Kationen metallisch sind.
Trend
Zu diesem Zeitpunkt können Sie vorhersagen, wie der metallische Charakter in der Periodenzüchter variiert. Wenn bekannt ist, dass Metalle große Metallfunkgeräte haben und dass es auch nur wenige Elektronegative gibt, sollten die schwersten Elemente (niedrigere Perioden) zu erwarten sind, die metallischsten sind. und die leichteren Elemente (die oberen Perioden), die am wenigsten Metallic.
Ebenso verringert der metallische Charakter desto elektronegativer das Element wird gemacht. Dies bedeutet, dass die Besichtigung der Perioden und Gruppen rechts von der Periodenzüchter in ihren höheren Perioden die geringsten metallischen Elemente erfüllen wird.
Daher nimmt der metallische Charakter durch Abstieg durch eine Gruppe zu und nimmt im gleichen Zeitraum nach rechts nach rechts ab. Unter den Metallelementen, die wir haben: Na (Natrium), Li (Lithium), Mg (Magnesium), Ba (Barium), Ag (Silber), Au (Gold), PO (Polonio), PB (Blei), CD (Cadmium ), Zu (Aluminium) usw.
Kann Ihnen dienen: Siedepunkt: Konzept, Berechnung und Beispiele-Ionisationsenergie
Wenn ein Atom einen großen Atomradius hat, wird erwartet, dass sein Kern die Elektronen in den äußersten Schichten nicht in erhebliche Festigkeit hält. Infolgedessen erfordert die Beseitigung des Atoms in einer Gasphase (individualisiert) nicht viel Energie. Dies ist Ionisierungsenergie, EI, notwendig, um ein Elektron wegzunehmen.
Es ist auch gleich zu sagen. Je kleiner das Atom und elektronegativer ist, desto niedriger ist es; Dies ist Ihre Tendenz.
Die folgende Gleichung zeigt ein Beispiel:
Na (g) => na+(g) + e-
Das Nötigste, dies zu erreichen, ist im Vergleich zur zweiten Ionisation nicht so groß:
N / A+(g) => na2+(g) + e-
Seit in na+ Positive Ladungen vorherrschen und das Ion ist kleiner als das neutrale Atom. Folglich der Kern von Na+ zieht mit einer viel größeren Kraft für Elektronen an, so dass es eine viel größere erfordert.
-Elektronische Affinität
Und schließlich gibt es die regelmäßige Eigenschaft der elektronischen Affinität. Dies ist der Energietrend, der das Atom eines Gasphasenelements für die Akzeptanz eines Elektrons enthält. Wenn das Atom klein ist und einen Kern mit einer großen Anziehungskraft hat, kann es für Sie leicht sein, das Elektron zu akzeptieren und einen stabilen Anion zu bilden.
Je stabiler das Anion in Bezug auf sein neutrales Atom ist, desto größer ist seine elektronische Affinität. Die Repulsionen zwischen denselben Elektronen kommen jedoch ebenfalls ins Spiel.
Stickstoff hat beispielsweise eine größere elektronische Affinität als Sauerstoff. Dies liegt daran, dass ihre drei Elektronen 2p verschwunden sind und weniger miteinander und das eingehende Elektron abweichen; Während im Sauerstoff gibt es ein Paar gepaarter Elektronen, die eine größere elektronische Abstoßung ausüben; Und im Fluorid gibt es zwei Paare.
Aus diesem Grund soll der Trend der elektronischen Affinitäten aus der dritten Periode der Periodenzüchter normalisiert werden.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Prof. Ortega Graciela m. (1. April 2014). Periodische Eigenschaften der Elemente. ABC -Farbe. Abgerufen von: ABC.com.Py
- Chemistry Librettexts. (7. Juni 2017). Periodeneigenschaften der Elemente. Erholt von: Chem.Librettexts.Org
- Helmestine, Anne Marie, ph.D. (2. Januar 2019). Die regelmäßigen Eigenschaften der Elemente. Erholt von: thoughtco.com
- TOPPR. (S.F.). Periodeneigenschaften von Elementen. Erholt von: topppr.com /
- Periodische Eigenschaften der Elemente: Eine Reise über den Tisch ist eine Reise durch Chemie. [PDF]. Erholt von: Kabeljau.Edu
- « Veralterung wahrgenommene Faktoren, Folgen und Beispiele
- Objektuelle Kunstgeschichte, Merkmale, Vertreter und Werke »

