Proteolysestypen und Funktionen
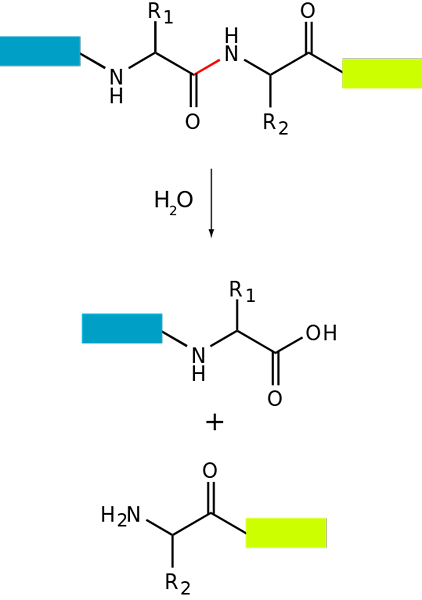
- 2390
- 70
- Tizian Liebich
Der Proteolyse o Proteinabbau ist ein Prozess, durch den ein Zellproteine vollständig abgebaut werden kann (sogar ihre Bestandteile Aminosäuren) oder teilweise (produzierende Peptide). Das heißt, es besteht aus der Hydrolyse eines oder mehrerer Peptidverbindungen, die ihre Aminosäuren zusammenhalten.
Dieser Prozess kann dank der Teilnahme anderer Proteine mit enzymatischer Aktivität auftreten, deren aktive Stellen die Hydrolyse der Verbindungen auftreten. Es kann auch durch nicht -enzymatische "Methoden" auftreten, wie durch Wirkung von Wärme oder Substanzen mit extremem pH -Wert (sehr sauer oder sehr grundlegend).
 Basic Proteolyse-Schema eines Proteins (Quelle: FDARDEL [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Basic Proteolyse-Schema eines Proteins (Quelle: FDARDEL [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Der Proteinabbau tritt sowohl in Bakterien als auch in Tieren und Pflanzen auf, ist jedoch besonders bei Tieren, insbesondere bei Verdauungssystemebene, vorhanden, da dies von der Verdauung und Darmabsorption der mit der Ernährung aufgenommenen Proteine abhängt.
Darüber hinaus ist die Proteolyse von größter Bedeutung für die funktionelle Aufrechterhaltung und Regulation mehrerer zellulärer Prozesse und hat auch mit der Eliminierung von Proteinen mit Übersetzung, Faltung, Verpackung, Import, Betrieb usw. zu tun.
Es ist wichtig zu beachten der entsprechenden Gene.
[TOC]
Arten der Proteolyse
Interne Proteine einer Zelle können zufällig oder selektiv abgebaut werden oder was gleich, kontrolliert oder nicht. Wie bereits erwähnt, kann dieser Prozess durch spezielle Enzyme oder aufgrund von Umgebungsbedingungen auftreten, die als saurer und/oder alkalischer pH definiert sind.
Kann Ihnen dienen: EpithelbeschichtungsgewebeEs ist wichtig zu erwähnen, dass jedes ordnungsgemäß übersetzte Protein, gefaltetes oder verpacktes eine oder mehrere Sequenzen von Abbausignalen verbirgt, die "kryptisch" sind und die exponiert werden können, wenn das Protein strukturell durch Temperatur, pH, pH, pH usw. gestört wird.
Ubiquitinierungs -Proteolyse
Ubiquitinierung (Ubiquitin-Protosom-System) ist ein System, mit dem Proteine selektiv hydrolysiert werden können.
Dieses System hat die Fähigkeit, Proteine zu erkennen und zu zerstören, die im Kern und im Cytosol gekennzeichnet sind, sowie Proteine, die während seiner Translokation vom Cytosol zum endoplasmatischen Retikulum nicht korrekt falten.
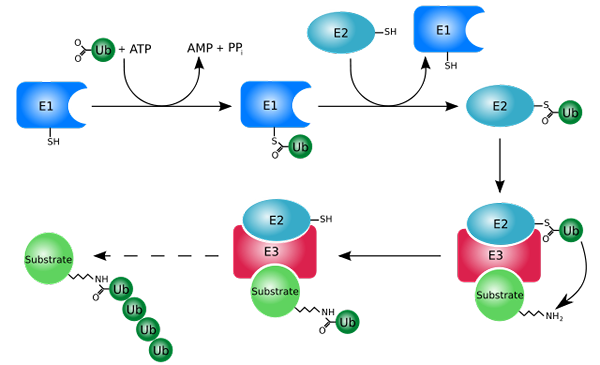 Markierungsprozess mit Ubiquitinas (Ubiquitinierung) (Quelle: Rogerdodd [CC BY-SA (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/)] über Wikimedia Commons)
Markierungsprozess mit Ubiquitinas (Ubiquitinierung) (Quelle: Rogerdodd [CC BY-SA (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/)] über Wikimedia Commons) Es wirkt hauptsächlich durch Zugabe oder Konjugation der "weißen" Proteine zu einem kleinen Protein oder Peptid von 76 Aminosäureabfällen, besser bekannt als Ubiquitin. Diese "markierten" Proteine durch Ubiquitinierung werden in kleinen Fragmenten durch das 26S -Proteosom abgebaut, eine Protease mehrerer Untereinheiten.
Autophagie -Proteolyse
Autophagie wird auch von einigen Autoren als eine Form der Proteolyse angesehen, mit der Unterscheidung, dass dies in einem geschlossenen Membrankompartiment auftritt.
Nicht -zymatische Proteolyse
Die Temperatur, der pH -Wert und sogar die Salzkonzentration eines Medium.
Funktionen
Die Proteolyse hat viele Funktionen in lebenden Organismen. Insbesondere hat es mit Protein Ersatz zu tun.
Kann Ihnen dienen: Ribosomen: Eigenschaften, Typen, Struktur, FunktionenProteine haben ein halbes Leben, das von einigen Sekunden bis zu einigen Monaten variiert und die Produkte ihres Abbaus, ob reguliert oder nicht, durch Enzyme vermittelt oder nicht, im Allgemeinen für die Synthese neuer Proteine wiederverwendet werden, die wahrscheinlich unterschiedliche Funktionen erfüllen.
Dies geschieht mit den Proteinen, die mit Nahrung verzehrt werden, die im Magen -Darm -Trakt durch Proteasen, einschließlich Tripsin und Pepsin, abgebaut sind. sowie mit einigen Zellproteinen, wenn den Zellen genug Nahrung fehlt, um zu überleben.
Intrazelluläre proteolytische Systeme erfassen und eliminieren "abnormal.
Die Akkumulation abnormaler Proteine im Zellinnen in Zellintern, entweder aufgrund von Defekten im internen proteolytischen System oder aus anderen Gründen, ist das, was viele Wissenschaftler als eine der Hauptursachen für das Altern in mehrzelligen Lebewesen betrachten.
Im Immunsystem
Die partielle Proteolyse vieler Proteine aus exogenen oder fremden Quellen, wie z. ein Oberflächenproteinsatz.
Diese Peptide können aus dem Ubiquitinierungssystem, autophagischen Prozessen oder nicht kontrollierten Proteolyseereignissen stammen.
Andere Funktionen
Eine weitere Funktion der begrenzten oder partiellen Proteolyse ist die Modifikation neu gebildeter Proteine, die als "Vorbereitung" für seine intra-extrazellulären Funktionen fungiert. Dies gilt zum Beispiel für bestimmte Hormone und für die an verschiedenen Stoffwechselprozessen beteiligten Proteine.
Es kann Ihnen dienen: Lymphaopoyese: Eigenschaften, Stufen, RegulierungDer programmierte Zelltod (Apoptose) hängt in hohem Maße von der "ortsspezifischen" Proteolyse ab, die begrenzt oder teilweise von intrazellulären Proteinen.
Extrazelluläre Regulationssysteme hängen auch von der ortsspezifischen Proteolyse ab, und das herausragendste ist das der Blutgerinnung.
Die allgemeine oder vollständige Proteolyse erfüllt auch die primären Funktionen für den selektiven Abbau der Proteine, deren Konzentration je nach physiologischer, metabolischer oder Zellentwicklungszustand sorgfältig kontrolliert werden muss.
In Pflanzen
Pflanzen verwenden auch proteolytische Prozesse zur Kontrolle vieler ihrer physiologischen und Entwicklungsaspekte. Es arbeitet beispielsweise bei der Aufrechterhaltung der intrazellulären Zustände und bei den Mechanismen der Reaktion auf stressige Zustände wie Dürre, Salzgehalt und Temperatur unter anderem.
Sowie bei Tieren die Proteolyse im Gemüse. In diesen Organismen ist die Proteolyse durch Ubiquitinierung eines der wichtigsten.
Verweise
- Alberts, geb., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Essentielle Zellbiologie. Garlandwissenschaft.
- Maurizi, m. R. (1992). Proteasense und Protein -Degraion in Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, a. (2005). Regulierter Proteinabbau. Trends in biochemischen Wissenschaften, 30 (6), 283-286.
- Vierstra, R. D. (neunzehn sechsundneunzig). Proteolyse in Pflanzen: Mechanismen und Funktionen. In der posttranskriptionellen Kontrolle der Genexpression in Pflanzen (PP. 275-302). Springer, Dordrecht.
- Wolf, d. H., & Messen, r. (2018). Mechanismen der Zellregulation-Protolyse, die große Überraschung. FEBS Letters, 592 (15), 2515-2524.
- « Paradise Ave -Eigenschaften, Lebensraum, Eigenschaften, Fortpflanzung, Pflege
- Trypanosoma Cruzi -Eigenschaften, Lebenszyklus, Krankheiten, Symptome »

