Faserproteine
- 3215
- 841
- Nick Laurén
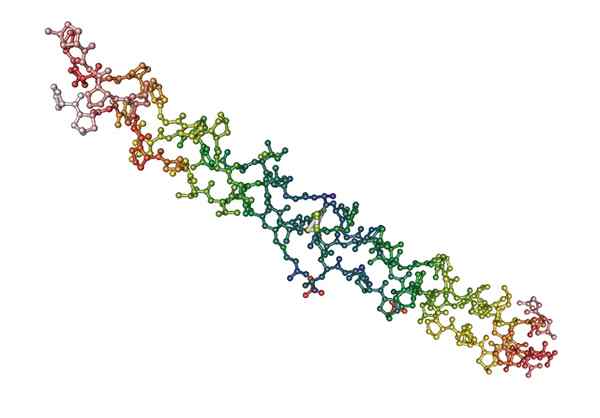
 Molekulare Struktur von Kollagen, ein fibröses Protein tierischer Herkunft (Quelle: Nevit Dilmen [CC BY-S (http: // creativecommons.Org/lizenzen/by-sa/3.0/)] über Wikimedia Commons)
Molekulare Struktur von Kollagen, ein fibröses Protein tierischer Herkunft (Quelle: Nevit Dilmen [CC BY-S (http: // creativecommons.Org/lizenzen/by-sa/3.0/)] über Wikimedia Commons) Was sind faserige Proteine?
Der Faserproteine, Sie sind auch als Skleroproteine bekannt und sind eine Klasse von Proteinen, die ein wichtiger Bestandteil der strukturellen Komponenten jeder lebenden Zelle sind. Kollagen, Elastin, Keratin oder Fibroin sind Beispiele für diese Art von Protein.
Sie erfüllen sehr vielfältige und komplexe Funktionen. Das Wichtigste sind die des Schutzes (wie die Dornen eines Stachelschweins) oder die Unterstützung (wie diejenigen, die Spinnen den Stoff liefert, das sie weben und die sie hängen halten).
Fibröse Proteine bestehen aus vollständig ausgedehnten Polypeptidketten, die organisiert sind und eine Art "Faser" oder "Seil" von großem Widerstand bilden. Diese Proteine sind mechanisch sehr stark und in Wasser unlöslich.
Zum größten Teil sind die Komponenten von faserigen Proteinen nacheinander wiederholte Aminosäurepolymere.
Die Menschheit hat versucht.
Struktur
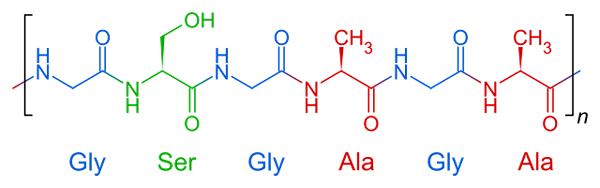 Wiederholte Struktur von Seidenfibroin, einem fibrösen Protein
Wiederholte Struktur von Seidenfibroin, einem fibrösen Protein Faserproteine haben eine relativ einfache Zusammensetzung in ihrer Struktur. Sie werden im Allgemeinen durch drei oder vier United Aminosäuren zwischen gebildet.
Das heißt, wenn ein Protein aus Aminosäuren wie Lysin, Arginin und Tryptophan besteht, wird die folgende Aminosäure, die sich dem Tryptophan anschließt.
Es gibt fibröse Proteine mit Aminosäuremotiven, die von zwei oder drei Aminosäuren, die sich von den sich wiederholenden Motiven ihrer Sequenzen unterscheiden.
Kann Ihnen dienen: ovuliparosDie Strukturen vieler faseriger Proteine wurden mit X -Strich -Kristallographie -Techniken und durch nukleare Magnetresonanzmethoden charakterisiert. Dank dessen werden Protein mit Faser -veranschlagt, röhrenförmig, laminar, spiralisch, "trichter" usw. detailliert usw. wurden usw.
Jedes Polypeptid von wiederholten Motiven einzigartig bildet ein Filament und jedes Filament ist eine Einheit der Hunderte von Einheiten, die die Ultrastruktur eines "faserigen Proteins" ausmachen. Im Allgemeinen ist jedes Filament in Bezug auf die anderen helikal verfügbar.
Funktionen
Aufgrund des Fasernetzes, das fibröse Proteine bildet.
Aus faserige Proteine bestehende Schutzstrukturen können die lebenswichtigen Organe vor Wirbeltieren vor mechanischen Schlägen, unerwünschten klimatischen Bedingungen oder räuberischem Angriff schützen.
Der Spezialisierungsniveau faseriger Proteine ist im Tierreich einzigartig. Spider Web zum Beispiel ist ein wesentlicher Unterstützungsgewebe für die Lebensweise, die Spinnen tragen. Dieses Material hat einen einzigartigen Widerstand und Flexibilität.

So sehr, dass derzeit viele synthetische Materialien versuchen, die Flexibilität und den Widerstand der Spinnennetz wiederherzustellen, selbst wenn transgene Organismen verwendet werden, um dieses Material durch biotechnologische Werkzeuge zu synthetisieren. Es ist jedoch zu beachten, dass der erwartete Erfolg noch nicht erzielt wurde.
Eine wichtige Eigenschaft, die faserige Proteine haben, ist, dass sie die Verbindung zwischen den verschiedenen Geweben von Wirbeltieren ermöglichen.
Es kann Ihnen dienen: Oxidorreduktasen: Eigenschaften, Struktur, Funktionen, BeispieleDarüber hinaus ermöglichen die vielseitigen Eigenschaften dieser Proteine lebende Organismen, Materialien zu erzeugen, die Resistenz und Flexibilität verbinden. Dies bildet in vielen Fällen die wesentlichen Komponenten für die Bewegung der Muskeln in Wirbeltieren.
Beispiele für faserige Protein
Kollagen
Es ist ein Protein tierischer Ursprung und ist vielleicht eines der am häufigsten vorkommenden Tiere von Wirbeltieren, da die meisten Bindegewebe bestehen. Das Kollagen fällt auf seine starken, erweiterbaren, unlöslichen und chemisch inerten Eigenschaften auf.
Komponieren - meistens - zu Haut, Hornhaut, Bandscheiben, Sehnen und Blutgefäßen. Eine Kollagenfaser besteht aus einem dreifachen parallelen Propeller, der fast im dritten Teil nur der Aminosäureglycin ist.
Dieses Protein bildet Strukturen.
Elastin
 Elastin der Pferde eines Pferdes. Quelle: Marta s. C. Godinho, Chavaunne T. Thorpe, Steve e. Greenwald & Hazel R. C. Bildschirm, CC BY-SA 4.0, über Wikimedia Commons
Elastin der Pferde eines Pferdes. Quelle: Marta s. C. Godinho, Chavaunne T. Thorpe, Steve e. Greenwald & Hazel R. C. Bildschirm, CC BY-SA 4.0, über Wikimedia Commons Elastin ist wie Kollagen ein Protein, das Teil des Bindegewebes ist. Im Gegensatz zum ersten bietet es jedoch Elastizität für Gewebe anstelle von Widerstand.
Elastinfasern bestehen aus Valin-, Prolin- und Glycin -Aminosäuren. Diese Aminosäuren sind stark hydrophobe Eigenschaften und es wurde festgestellt, dass die Elastizität dieses faserigen Proteins auf elektrostatische Wechselwirkungen in seiner Struktur zurückzuführen ist.
Elastin ist in Geweben, die intensiv Erweiterungs- und Relaxationszyklen ausgesetzt sind, reichlich vorhanden. In Wirbeltieren befindet es sich in Arterien, Bändern, Lungen und Haut.
Keratin
 Keratin. Quelle: Maksim, CC BY-SA 3.0, über Wikimedia Commons
Keratin. Quelle: Maksim, CC BY-SA 3.0, über Wikimedia Commons Keratin ist ein Protein, das überwiegend in der ektodermalen Schicht von Wirbeltieren liegt. Dieses Protein bildet wichtige Strukturen wie Haare, Nägel, Dornen, Federn, Hörner unter anderem.
Es kann Ihnen dienen: Flora und Fauna des tropischen WaldesKeratin kann aus α-Queratin oder β-Cheratin bestehen. Α-Queratin ist viel starrer als β-Cheatin. Dies liegt daran, dass Keratin-α aus α-Propeller besteht.
In β-that dagegen besteht es in einem größeren Anteil an polaren und apolaren Aminosäuren, die Wasserstoffbrücken bilden und in gefalteten β-Blättern organisieren können. Dies bedeutet, dass seine Struktur weniger resistent ist.
Fibroin
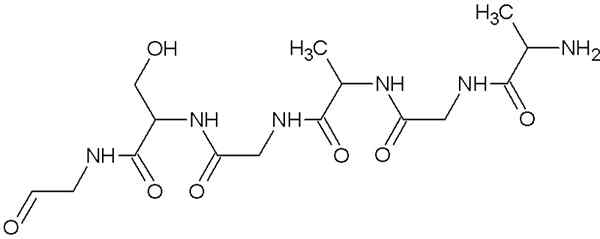 Molekülstruktur von Fibroin
Molekülstruktur von Fibroin Dies ist das Protein, das Spinnennetz und Stränge umfasst, die von Seidenwürmern produziert werden. Diese Fäden bestehen hauptsächlich aus Glycin-, Serin- und Alanin -Aminosäuren.
Die Strukturen dieser Proteine sind β -Blätter organisierte Antiparallela zur Ausrichtung des Filaments. Dieses Merkmal verleiht ihm Widerstand, Flexibilität und wenig Distriktkapazität.
Das Fibroin ist in Wasser nicht sehr löslich und verdankt seine große Flexibilität der großen Starrheit, die die Vereinigung von Aminosäuren in seiner Primärstruktur und der Vander Waals -Brücken, die zwischen den Sekundärgruppen der Aminosäuren gebildet werden, gebildet.

