Eigenschaften Globuläre Proteine, Struktur, Beispiele
- 2694
- 441
- Medine Kedzierski
Der Globuläre Proteine Es sind Proteine mit einer Tertiärstruktur, in der Peptidketten in einem globulären Erscheinungsbild fixiert sind. Ein Großteil der Zellproteine entspricht dieser Gruppe, wobei die Proteine mit enzymatischer Aktivität von den wichtigsten sind.
Proteine repräsentieren eine ganz besondere Art von Molekülen in Zellen, die alle Lebewesen bilden. Seine Struktur besteht aus einer Kombination von 20 Aminosäuren, die in unterschiedlichen Anteilen wiederholt werden und die durch chemische Verbindungen in einer genetisch bestimmten Reihenfolge oder Sequenz aneinander binden.
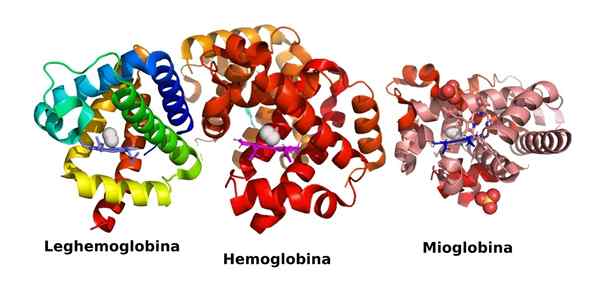 Struktur von drei kugelförmigen Proteinen, die Sauerstoff transportieren: Leghemoglobin, Hämoglobin und Myoglobin (Quelle: Veronica Stafford/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0) über Wikimedia Commons)
Struktur von drei kugelförmigen Proteinen, die Sauerstoff transportieren: Leghemoglobin, Hämoglobin und Myoglobin (Quelle: Veronica Stafford/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0) über Wikimedia Commons) Sie sind äußerst reichlich vorhanden und erfüllen wesentliche Funktionen aus vieler Sicht des Zelllebens, sodass ohne sie die Existenz des Lebens, wie wir wissen, nicht möglich wäre.
Jede Art, auf der Erde zu leben, hat einen bestimmten Satz von Protein und mehr.
[TOC]
Kugelförmige und faserige Proteine
Wissenschaftler, die sich der Untersuchung von Proteinen gewidmet haben. Daher können Proteine nach der drei -dimensionalen Struktur faserig oder globulär sein.
Faserproteine sind solche, die ein längliches Aussehen haben, da ihre Peptidketten im Allgemeinen parallel zueinander sind. Diese Proteine haben viele Funktionen, aber das Wichtigste muss mit der Struktur, Unterstützung und Zellbiomechanik zu tun haben.
Zwei klassische Beispiele für faserige Proteine im menschlichen Körper und andere Tiere sind die Keratin und das Kollagen, Das beteiligt sich an der Bildung von Haaren und Nägeln (die ersten) und Haut, Knochen und Sehnen (die letzten).
Globuläre Proteine hingegen sind Proteine mit einer abgerundeten oder kugelförmigeren dreidimensionalen Konformation, sodass sie etwas kompakter und unregelmäßiger erscheinen können. Diese Proteine nehmen nicht direkt von der Zellstruktur teil, haben aber eine grundlegende funktionelle Rolle.
Kann Ihnen dienen: Taxismus Hämoglobinstruktur
Hämoglobinstruktur Beispiele für globuläre Proteine sind Proteine mit enzymatischer Aktivität (Enzyme) wie z Hämoglobin, das nimmt am Transport von Sauerstoff durch das Blut und die beteiligt Immunglobuline, das funktioniert im Immunsystem von Säugetieren.
Eigenschaften von kugelförmigen Proteinen
Löslichkeit
Globuläre Proteine sind teilweise löslich im Wasser, Aspekt von großer Bedeutung, da diese in der wässrigen Umgebung des Cytosols und im Lumen der verschiedenen Zellorganellen, in denen sie ihre Funktionen ausüben, wirklich reichlich vorhanden sind.
Struktur
Während fibröse Proteine fast immer durch eine sich wiederholende Art von Sekundärstruktur gebildet werden, sind globuläre Proteine heterogener, da sie durch die Präsentation ihrer Peptidketten verschiedene Arten von Sekundärstrukturen gekennzeichnet sind, die sich gegenseitig falten.
Funktionen
In der Gruppe der globulären Proteine befinden sich alle Enzyme, eine große Menge von Transportproteinen, regulatorische Proteine, motorische Proteine und vieles mehr, sodass es eine sehr vielfältige Gruppe ist, sowohl aus Sicht der Struktur und Größe.
Konformation
Neben faserigen Proteinen gilt alle Informationen, die erforderlich sind, um die Faltung und strukturelle Konformation von kugelförmigen Proteinen zu erreichen.
Einstufung
Im Allgemeinen werden diese Proteine nach ihrer Funktion klassifiziert, und jede Kategorie ist auch in viele Unterkategorien unterteilt. Ein gutes Beispiel hierfür ist die Klassifizierung von Enzymen, die derzeit auf der Art der Reaktion basiert, an der sie teilnehmen.
Struktur von kugelförmigen Proteinen
Globuläre Proteine werden dank der nativen Konformation ihrer tertiären Strukturen definiert, bei denen die Aminosäurungsketten zu einer relativ kugelförmigen Struktur untergebracht sind, die normalerweise mit hydrophilen Aminosäuren (die mit Wasser interagieren) gepolstert werden, die einen hydrophobischen Nucleus (mehr hydrophobischem Nukleu ( was nicht mit Wasser interagiert).
Kann Ihnen dienen: Tumornekrosefaktor (TNF): Struktur, Wirkungsmechanismus, FunktionPrimär- und Sekundärstruktur
Wie faserige Proteine haben kugelförmige Proteine eine Primärstruktur, die durch die lineare Kette der Aminosäuren gebildet wird, die sie ausmachen, die in Alpha -Propellern oder Beta -Blättern untergebracht sind, wodurch die Sekundärstruktur entsteht.
Tertiär- und Quartärstruktur
Die tertiäre Struktur von kugelförmigen Proteinen wird spontan gebildet und durch die Wechselwirkungen zwischen den Aminosäureketten aufrechterhalten, die sie ausmachen.
Es handelt. Es wird durch die Wechselwirkungen zwischen den verschiedenen Sekundärstrukturen bestimmt, die in derselben Polypeptidkette bestehen können.
Es wurde festgestellt, dass die Kräfte, die die Wechselwirkung zwischen diesen Ketten aufrechterhalten Links).
Darüber hinaus haben viele globuläre Proteine, insbesondere große, unterschiedliche "Lappen" oder "Domänen", die möglicherweise unterschiedliche Funktionen innerhalb desselben Moleküls haben können.
Ebenso werden einige globuläre Proteine in der Natur als große Proteinkomplexe gefunden, die aus diskreten (getrennten) Polypeptidketten bestehen, auch bekannt als Untereinheiten, Es wird also gesagt, dass sie Proteine mit quaternären Strukturen sind.
Beispiele für kugelförmige Proteine
Es gibt viele Beispiele für kugelförmige Proteine, einige wichtige für Zellulare und andere nicht so sehr, aber was ist der Fall, immer seine Struktur hängt mit seiner Funktion zusammen.
Auf zellulärer Ebene können wir also über einige der Proteine sprechen, die an den wichtigsten Stoffwechselwegen teilnehmen, wie z. B.:
HExoquinase
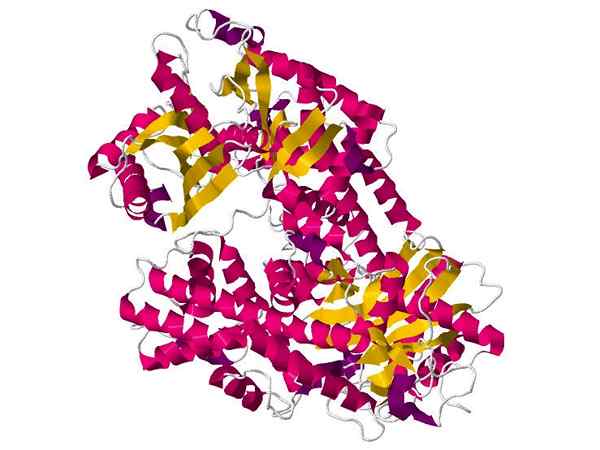 Hexoquinase
Hexoquinase Es ist ein relativ kleines kugelförmiges Protein, das in fast allen lebenden Zellen vorkommt, wo es für die Katalyse der Phosphorylierungsreaktion von Glukoseabfällen im ersten Teil des glykolytischen Weges verantwortlich ist.
SUccinato -Dehydrogenase
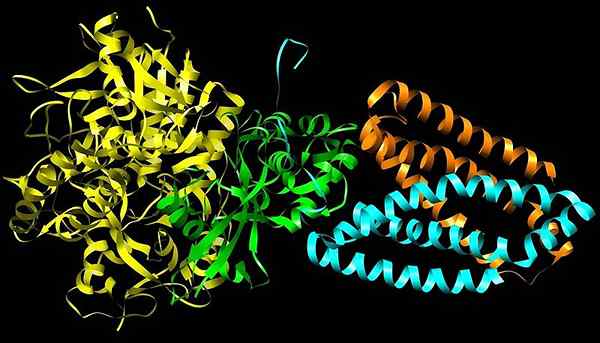 Große Dehydrogenase
Große Dehydrogenase Es handelt.
Kann Ihnen dienen: Biotische und abiotische Faktoren des DschungelsIm menschlichen Körper und in der anderer Tiere gibt es auch andere sehr wichtige Proteine wie Hämoglobin und Immunglobuline.
HEmoglobin
 Hämoglobin
Hämoglobin Es handelt. Dies befindet sich in den roten Blutkörperchen, wo sie am Sauerstofftransport zu den Geweben beteiligt ist.
MIoglobin
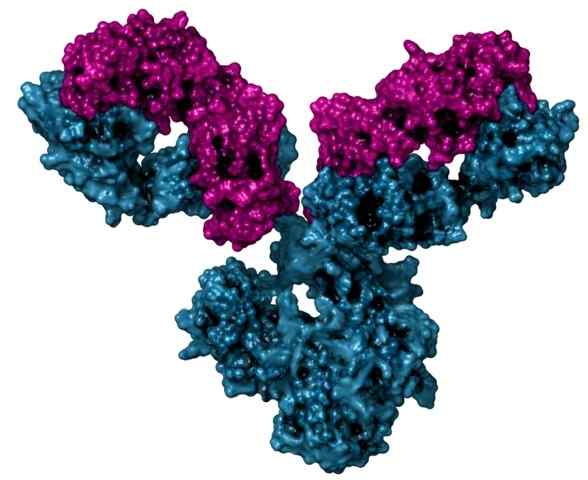 Struktur eines Immunglobulins, auch Antikörper genannt
Struktur eines Immunglobulins, auch Antikörper genannt Es ist auch ein globuläres Protein, das an Sauerstoff bindet, dies jedoch nur eine Tertiärstruktur aufweist und ausschließlich in den Skelettmuskelzellen von Wirbeltieren gefunden wird.
YoNmunoglobuline
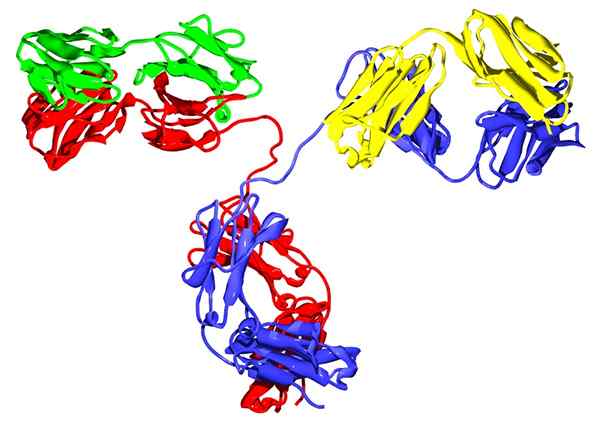 IgG2 Immunglobulin
IgG2 Immunglobulin Sie sind globuläre Glykoproteine, die bei vielen Tieren vorhanden sind, insbesondere in Blut-, Lymphe- und vaskularisierten Geweben, wo sie Funktionen als Mitglieder des Immunsystems ausüben.
Neben Hämoglobin- und Succinat -Dehydrogenase haben diese Proteine eine quaternäre Struktur, da sie durch zwei Paare von Untereinheiten gebildet werden: zwei schwere Ketten und zwei leichte Ketten.
Aquaporin
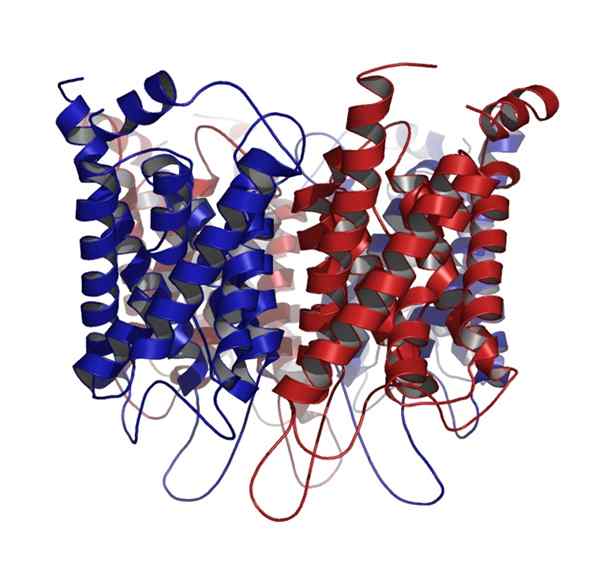 Aquaporin
Aquaporin Ein weiteres globuläres Protein, das in tierischen und pflanzlichen Zellen häufig vorkommt, ist das Protein, das die membranalen Kanäle für den Wassertransport bildet, besser bekannt als Aquaporin.
Aquaporine werden als kugelförmige Proteine eingestuft, aber es handelt sich um umfassende Membranproteine, die in quaternären Strukturen fixiert sind, die von mehreren identischen Untereinheiten gebildet werden.
Verweise
- Chan, h. S., & Dill, k. ZU. (1990). Ursprünge der Struktur in kugelförmigen Proteinen. Proceedings der National Academy of Sciences, 87 (16), 6388-6392.
- Dankbar, k., & Prossa, s. (2007). Immunglobuline.
- Gromiha, m. M. (2010). Bioinformatikprotein: von Sequenz zu Funktion. Akademische Presse.
- Gromiha, m. M., Nagarajan, r., & Sailvaraj, s. (2019). Bioinformatik -Strukturprotein: Ein Überblick.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Verkman a. S. (2013). Aquaporine. Aktuelle Biologie: CB, 23 (2), R52-R55. https: // doi.org/10.1016/j.Jungtier.2012.elf.025

