Katalase -Teststiftung, Technik und Verwendung

- 2806
- 237
- Lewis Holzner
Der Katalase Es ist eine Methodik, die in Bakteriologie -Labors verwendet wird, um das Vorhandensein von Enzymkatalase in diesen Bakterien hervorzuheben, die sie besitzen. Neben Grams Färbung befinden sich die Haupttests, die an frisch isolierten Mikroorganismen durchgeführt werden sollten. Diese Tests führen den Mikrobiologen in den Schritten, um die endgültige Identifizierung des betreffenden Mikroorganismus zu befolgen.
Im Allgemeinen haben Bakterien, die Cytochrom enthalten. Es gibt jedoch Ausnahmen wie Streptococcus, die trotz optionaler anaerobe Mikroorganismen das Katalaseenzym nicht besitzen.
 Ausführung des Katalasetests, der eine positive Reaktion zeigt. Quelle: Kein maschinenlesbarer Autor zur Verfügung gestellt. Nase nahm an (basierend auf Urheberrechtsansprüchen). [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]
Ausführung des Katalasetests, der eine positive Reaktion zeigt. Quelle: Kein maschinenlesbarer Autor zur Verfügung gestellt. Nase nahm an (basierend auf Urheberrechtsansprüchen). [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]] Aus diesem Grund wird der Katalasetest hauptsächlich zur Unterscheidung von Staphylococaeee und Mikrococaceae (beide positive Katalase) der Streptococaee -Familie (negative Katalase) (negative Katalase) verwendet.
Ebenso unterscheidet sich die Gattung Bacillus (positive Katalase) unter anderem von der Gattung Clostridium (negative Katalase).
[TOC]
Basis
Katalase ist ein als Hydroperoxidase klassifiziertes Enzym. Dies bedeutet, dass sie Wasserstoffperoxid als Substrat verwenden (H)2ENTWEDER2).
Es wird auch als Oxidoreduktase angesehen, da in der Reaktion, bei der es ein Element gibt, das als Spender von Elektronen (Reduktionssubstanz) und als Elektronenempfänger (oxidierende Substanz) dient, dient (oxidierende Substanz).
Katalase ist ein Protein, das eine prostorische Gruppe mit vier trivalisierenden Eisenatomen enthält (Faith+++), deshalb ist es ein Homoprotein. Das Eisenion bleibt während der Reaktion oxidiert.
Es kann gesagt werden, dass Katalase ein entgiftendes Enzym ist, da ihre Funktion darin besteht, Substanzen zu eliminieren, die während des Bakterienstoffwechsels auftreten. Unter diesen Substanzen ist Wasserstoffperoxid.
Wasserstoffperoxid wird aus der Zersetzung von Zucker durch Aerobic gebildet. Dieser Prozess erfolgt wie folgt:
Das Superoxid -Ion (oder2-) (Freiradikal) wird als Endprodukt der Assimilation von Glucose durch aerobe Straße gebildet. Dies ist toxisch und wird durch das Enzym -Superoxiddysmutase eliminiert, das es in gasförmige Sauerstoff und Wasserstoffperoxid umwandelt.
Es kann Ihnen dienen: Holdridge Lebenszonen: Was ist in LateinamerikaWasserstoffperoxid ist auch für Bakterien toxisch und muss beseitigt werden. Das Katalaseenzym entfaltet Wasserstoffperoxid in Wasser und Sauerstoff.
Katalase kann auf andere Substrate als Wasserstoffperoxid wie Alkohole, Aldehyde, Säuren, aromatische Amine und Phenole wirken. Wasserstoffperoxid kann jedoch auch durch Katalase verwendet werden, um andere toxische Verbindungen wie Methyl und Ethylalkohol zu oxidieren.
Ebenso ist Katalase in phagozytischen Zellen vorhanden, die sie vor der toxischen Wirkung von Wasserstoffperoxid schützt.
Routinetechnik für den Katalasetest
-Methode in der Folie
Materialien
3% Wasserstoffperoxid (10 Volumina).
Tragbare Lamina
Einweg -Plastikgriff oder Holzstock.
Verfahren
Nehmen Sie ausreichend viel von der Kolonie, um zu studieren, ohne den Agar zu berühren, aus dem er stammt. Die Kolonie muss frisch sein, dh aus einer Ernte von 18 bis 24 Stunden.
Legen Sie die Kolonie auf den Trockenhalter und fügen Sie einen Tropfen von 3% Wasserstoffperoxid hinzu (Sie können auch H verwenden2ENTWEDER2 bei 30%). Beobachten Sie sofort, ob Blasen abgelöst werden oder nicht.
Deutung
Positive Reaktion: Gasablösung, die durch die Bildung von Blasen (starke Blase) ersichtlich ist.
Negative Reaktion: Es gibt keine Blasenbildung.
-Direkte Methode in der reinen Kultur
Platzieren Sie 1 ml H2ENTWEDER2 3% auf reiner Ernte in Platten oder Keilen, die kein Blut enthalten (vorzugsweise nahrhafter Griff). Beachten Sie, ob es sofort Blasenbildung gibt oder nicht. Sie können auch H verwenden2ENTWEDER2 30%.
Es wird genau wie die Objekthalter -Methode interpretiert.
-Methode mit Kapillar oder Pilz und Petrishko Tube
Füllen Sie ein 67 mm Kapillarrohr in einer Höhe von 20 mm mit 3% Wasserstoffperoxid pro Kapillarität.
Berühren Sie die isolierte Kolonie, die Sie mit der Kapillare voller H studieren möchten2ENTWEDER2 3%. Beachten Sie, ob die Kapillare in ungefähr 10 Sekunden mit Blasen gefüllt ist. Diese Methode ermöglicht es, die Reaktion bei Kreuzen zu halbquantifizieren:
Ohne Kreuze gibt es keine Blasen (negative Reaktion).
Kann Ihnen dienen: Flora und Fauna der Falklandinseln: herausragende Arten+ --Knappe Blasen (schwache oder verzögerte Reaktion).
++ -Reichlich Blasen (mäßige Reaktion).
+++ -Blasen erreichen das entgegengesetzte Ende (energetische Reaktion).
-Taylor- und Achanzar -Methode für Katalasetests, die zweifelhaft machen
In einem sauberen und trockenen Objektträger eine isolierte Kolonie platziert und dann einen Tropfen h platzieren2ENTWEDER2 0,5% und bedecken Sie sie mit einem Abdeckungen. Beachten Sie, ob es eine Bildung von inhaftierten Blasen gibt oder nicht.
Interpretation: Das Vorhandensein von Blasen zeigt eine positive Reaktion an. Ohne Blasen wird es als negative Reaktion interpretiert.
Katalasetest für Mycobacterium -Arten
Diese Technik muss durch Kontrolle des pH -Werts und der Temperatur durchgeführt werden. Es muss unter einer laminaren Flussglocke ausgeführt werden, da die Manipulation der verschiedenen Arten von Mycobacterium gefährlich ist.
-Materialien
30% oder 110 Volumen Wasserstoffperoxid (Superoxal).
Phosphatpuffer pH 7
Tween 80 bis 10%
Mykobakteriumkultur im Keil von 3 bis 4 Wochen
-Vorbereitung von Reagenzien
Phosphatpuffer pH 7
Wiegen:
1.361 g (kh2Po4) Anhydra.
1,420 g (Na2HPO3) dysodischer Phosphat wasserfrei.
Lösen Sie beide Salze in etwas sterilem destilliertem Wasser und komplett mit Wasser bis zu 1000 ml.
Tween 80 bis 10%
Führen Sie eine 1:10 Verdünnung der Tween 80 durch, die kommerziell konzentriert wird, damit dies wie folgt fortgesetzt wird:
Nehmen Sie 1 ml Tween 80 und legen Sie es in ein wenig destilliertes Wasser, lösen Sie das Volumen mit Wasser bis zu 10 ml.
Final Reagenz
Mischen Sie eine Menge Phosphatpuffer mit einer Menge von Tween 80 bis 10% (in gleichen Teilen). Definieren Sie im Labor, wie viel Sie vorbereiten möchten.
-Verfahren
Platzieren Sie 5 ml Phosphatpuffer in ein steriles Testrohr mit Fadendeckel (Baquelita).
Nehmen Sie mit einem Inokulationsgriff genügend Kolonie von einem Wachstum von Mycobacterium, die in Keilen gesät und sich im Phosphatpuffer auflösen.
Decken Sie das Röhrchen ab, ohne den Faden festzuziehen. Platzieren Sie 20 bis 30 Minuten in einem Badezimmer bei 68 ° C. Nehmen Sie mit 22-25 ° C aus und kühlen Sie sie ab
Messen Sie 0,5 ml des endgültigen Reagens (Mischung) und fügen Sie es mit der kalten Lösung zum Röhrchen hinzu. Blasenbildung beobachten oder nicht.
Es wird ebenso interpretiert wie die vorherigen Techniken.
Verwenden
Wenn ein Wachstum von Kolonien in angereicherten Medien erhalten wird, muss eine Grammfärbung und ein Katalase -Test an die erhaltenen Kolonien durchgeführt werden. Dadurch wird der Mikrobiologe zu den Verfahren geleitet, die zur endgültigen Identifizierung befolgt werden sollen.
Kann Ihnen dienen: Einfaches flaches Epithel: Eigenschaften, Funktionen und Typen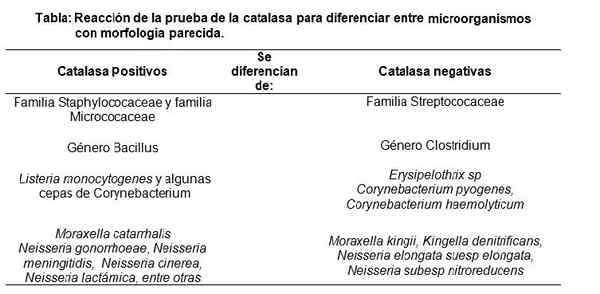 Quelle: Vorbereitet vom Autor MSC. Marielsa Gil
Quelle: Vorbereitet vom Autor MSC. Marielsa Gil QA
Um die ordnungsgemäße Funktion des Wasserstoffperoxidreagens zu bewerten, verwenden Sie frisch kultivierte Kontrollen, wie z Staphylococcus aureus als positive Kontrolle und Stämme von Streptococcus sp als negative Kontrolle.
Eine weitere Alternative, die als positive Kontrolle dient.
Sie können einen Schokoladenagar als negative Kontrolle verwenden, hier sind die Erythrozyten bereits aufgelistet und der Test gibt negativ.
Einschränkungen
-Verwenden Sie keine alten Kulturen für den Test, da dies falsche Negative verursachen kann.
-Vermeiden Sie es, Kolonien aus Kulturen im Blutagar zu nehmen, wenn Sie darauf achten, den Agar nicht zu berühren. Dieses Verfahren kann falsch positive Ergebnisse verursachen, da Erythrozyten eine Katalase enthalten.
-Wenn Sie die Kolonie mit einem Platin -Griff nehmen, investieren Sie nicht die Reihenfolge des Verfahrens, da dies falsch positiv ist. Dies liegt daran, dass Platin in der Lage ist, mit Wasserstoffperoxid zu reagieren und eine Blase zu entstehen.
-Verwenden Sie das Wasserstoffperoxidreagens nicht, wenn es sehr alt ist, da das Reagenz sehr instabil ist und im Laufe der Zeit zusammenbricht.
-Halten Sie das Reagenz von Wasserstoffperoxid vor Licht und Kühlung geschützt, um Schäden zu vermeiden.
-Führen Sie jedes Mal, wenn es verwendet wird, eine Qualitätskontrolle für das Wasserstoffperoxidreagens durch.
-Berücksichtigen Sie, dass wenn H verwendet wird2ENTWEDER2 Bei 30% sind die Reaktionen stärker als die mit H durchgeführten2ENTWEDER2 3%.
Verweise
- Koneman E, Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. 5. ed. Pan -American Editorial s.ZU. Argentinien.
- Forbes B, Sahm D, Weissfeld A. (2009). Mikrobiologische Diagnose von Bailey & Scott. 12 ed. Pan -American Editorial s.ZU. Argentinien.
- Mac Faddin J. (2003). Biochemische Tests zur Identifizierung klinischer Bedeutung Bakterien. 3. Aufl. Pan -American Editorial. Buenos Aires. Argentinien.
- BD Laboratories. Katalase -Reagenz. Verfügbar unter: http: // winklerltda.Cl
- Vadequímica Laboratories. Wasserstoffperoxid. Äquivalenz zwischen Volumen und Prozentsatz. Erhältlich bei: Vadequimica.com
- « Komplementäre Ereignisse Was sie bestehen und Beispiele
- Josep Carner Biographie, Stil und Arbeiten »

