Äquivalenzpunkt

- 4906
- 401
- Medine Kedzierski
 Der Äquivalenzpunkt ist die Konzentration von stöchiometrisch zu einem Mehrwert, der der Menge des Analyten entspricht
Der Äquivalenzpunkt ist die Konzentration von stöchiometrisch zu einem Mehrwert, der der Menge des Analyten entspricht Was ist der Äquivalenzpunkt?
Er Äquivalenzpunkt Es ist eines, in dem zwei chemische Substanzen vollständig reagiert wurden. Bei Säure-Base-Reaktionen zeigt dieser Punkt an, wann eine ganze Säure oder eine Base neutralisiert wurde.
Dieses Konzept ist täglich in volumetrischen Graden oder Bewertungen und wird durch einfache mathematische Berechnungen bestimmt.
In dieser Hinsicht ist ein Grad der Prozess, bei dem ein Volumen einer bekannten Konzentrationslösung sorgfältig hinzugefügt wird, die als Titel als unbekannte Konzentrationslösung bezeichnet wird, um seine Konzentration zu erhalten.
Die Verwendung eines pH -Indikators ermöglicht es, den Moment zu kennen, in dem der Grad endet. Der Indikator wird zu der Lösung hinzugefügt, die den Titel zur Quantifizierung der Konzentration durchführt, die Sie wissen möchten.
Ein Säure-Base-Indikator ist eine chemische Verbindung, deren Farbe von der Wasserstoffkonzentration oder dem pH-Wert des Mediums abhängt.
Die Farbänderung des Indikators zeigt den Endpunkt des Grades an, obwohl nicht der Äquivalenzpunkt. Im Idealfall müssen beide Punkte zusammenfallen.
Was ist der Äquivalenzpunkt?
Eine Lösung einer unbekannten Konzentrationssäure in einen Kolben.
Die Auswahl eines Indikators muss so getroffen werden.
Dies ist der Äquivalenzpunkt, während der Punkt, an dem ein Indikator die Farbe ändert.
Kann Ihnen dienen: Hypotonische Lösung: Komponenten, Vorbereitung, BeispieleEndpunkt
Die Ionisation oder Dissoziation des Indikators wird wie folgt dargestellt:
Hin +h₂o in- + H3ENTWEDER+
Und hat deshalb eine konstante KA
Ka = [h3ENTWEDER+] [In-] / [Hin]
Die Beziehung zwischen dem nicht issoziierten Indikator (Hin) und dem dissoziierten Indikator (in-) Bestimmen Sie die Farbe des Indikators.
Die Zugabe einer Säure erhöht die HIN -Konzentration und erzeugt die Farbe 1 des Indikators. In der Zwischenzeit begünstigt die Zugabe einer Basis einen Anstieg der Konzentration des dissoziierten Indikators (in-) (Farbe 2).
Es ist wünschenswert, dass der Äquivalenzpunkt mit dem Endpunkt zusammenfällt. Dazu wird ein Indikator mit einem Farbänderungsintervall ausgewählt, das den Äquivalenzpunkt enthält. Darüber hinaus geht es darum, einen Fehler zu reduzieren, der einen Unterschied zwischen dem Äquivalenzpunkt und dem Endpunkt erzeugt.
Die Standardisierung oder Bewertung einer Lösung ist ein Prozess, bei dem die genaue Konzentration einer Lösung bestimmt wird. Es ist methodisch ein Abschluss, aber die folgende Strategie ist anders.
Eine Lösung des primären Standards wird in den Kolben platziert und die standardisierte Titellösung wird mit einer Bürette hinzugefügt.
Äquivalenz der Titration einer starken Säure mit einer starken Basis
100 ml 0,1 M HCl werden in den Kolben platziert und mithilfe einer Bürette eine 0,1 m NaOH -Lösung nach und nach hinzugefügt, um die pH -Veränderungen der Lösung zu bestimmen, die Salzsäure verursacht.
Vor dem Hinzufügen von NaOH ist der pH -Wert der HCL -Lösung zunächst 1 1.
Die starke Base (NaOH) wird zugesetzt und der pH -Wert steigt allmählich an, bleibt jedoch ein saurer pH -Wert, da überschüssige Säure diesen pH -Wert bestimmt.
Kann Ihnen dienen: Kaliumiodid (KI): Struktur, Eigenschaften, erhalten, verwendet, RisikenWenn NaOH weitergeht, gibt es eine Zeit, in der der Äquivalenzpunkt erreicht ist, in dem der pH -Wert neutral ist (pH = 7). Die Säure hat mit der Basis reagiert, aber es gibt noch keinen Überschuss an Basis.
Die Konzentration von Natriumchlorid überwiegt, das ein neutrales Salz ist (noch das Na+ Noch der Cl- sind hydrolysiert).
Wenn NaOH weitergeht, nimmt der pH weiter.
Im Idealfall sollte die Farbänderung des Indikators zu einem pH = 7 auftreten, aber aufgrund der abrupten Form der Titelkurve kann Phenolphthalein verwendet werden, der sich zu einer hellrosa Farbe zu einem pH -Wert um 8 ändert.
Sturzbasierte Abschlusskurve auf der schwachen Basis
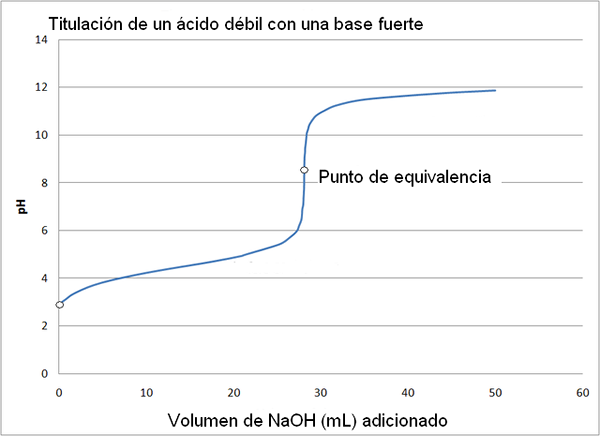 Schwache Säure- und starke Basen -Titrationskurve. Quelle: Wikimedia Commons
Schwache Säure- und starke Basen -Titrationskurve. Quelle: Wikimedia Commons Die Titrationskurve einer starken Säure mit einer starken Base ähnelt der des oberen Bildes. Der einzige Unterschied zwischen beiden Kurven besteht darin, dass der erste eine viel abruptere pH -Veränderung hat, während in der Titrationskurve einer schwachen Säure mit einer starken Basis ersichtlich ist, dass die Veränderung allmählicher ist.
In diesem Fall wird eine schwache Säure mit dem Titel wie Essigsäure (CH3COOH) mit einer starken Basis, Natriumhydroxid (NaOH). Die Reaktion, die im Grad auftritt, kann sich wie folgt schematisieren:
Naoh +ch3Cooh => ch3Gurren-N / A+ + H₂o
In diesem Fall wird die Acetatpufferlösung mit einem PKA = 4,74 gebildet. Die gepolsterte Region ist in der leichten und fast unmerklichen Veränderung vor pH 6 zu sehen.
Es kann Ihnen dienen: eine Amino -Gruppe (NH2): Struktur, Eigenschaften, BeispieleDer Äquivalenzpunkt, wie durch das Bild angegeben, liegt bei 8,72 und nicht 7. Das liegt daran, dass Cho3Gurren- Es ist ein Anion, das nach Hydrolyzar OH erzeugt-, das stützt den pH:
CH3Gurren- + H₂o ch3Cooh +oh-
Stufen
Essigsäure -Titration durch Natriumhydroxid kann in 4 Stadien zur Analyse unterteilt werden.
- Bevor Sie anfangen, die Base (NaOH) hinzuzufügen, ist der pH -Wert der Lösung sauer und hängt von der Dissoziation von Essigsäure ab.
- Wenn Natriumhydroxid zugesetzt wird.
- Der pH -Wert des Äquivalenzpunkts tritt zu einem pH -Wert von 8,72 auf, der offen alkalisch ist.
Der Äquivalenzpunkt hat keinen konstanten Wert und variiert abhängig von den im Grad beteiligten Verbindungen.
- Durch weiterhin NaOH addiert nach Erreichen des Äquivalenzpunkts der pH -Wert aufgrund von überschüssigem Natriumhydroxid.
Indikatorauswahl gemäß dem Äquivalenzpunkt
Phenolphthalein ist nützlich, um den Äquivalenzpunkt in diesem Grad zu bestimmen, da es seinen Farbwendepunkt in einem pH -Wert um 8 hat, der in den pH -Bereich der Titration von Essigsäure fällt, die die Punktäquivalenz enthält (pH = 8,72).
Andererseits ist Methylrot nicht nützlich, um den Äquivalenzpunkt zu bestimmen, da es die Farbe im pH -Wert von 4,5 bis 6,4 verändert.
Verweise
- Helmestine, Anne Marie. Äquivalenzpunktdefinition. Von Thakedco erholt.com
- Unterschied zwischen Endpunkt und Äquivalenzpunkt. Aus Differenzweiten abgerufen.Netz
- Äquivalenzpunkt: Definition und Berechnung. Studie erholt sich.com

