Was ist chemische Kinetik?

- 5101
- 1632
- Joy Hort
Wir erklären, was chemische Kinetik, Ordnung und Reaktionsgeschwindigkeit ist und welche Faktoren die Geschwindigkeit beeinflussen
Was ist chemische Kinetik?
Der Chemische Kinetik Es ist der Zweig der Chemie, der für die Untersuchung der Geschwindigkeit chemischer Reaktionen verantwortlich ist, welche Faktoren diese Geschwindigkeit beeinflussen und welche individuellen Mechanismen oder Schritte chemische Reaktionen auftreten.
Darüber hinaus ermöglicht es uns, viele Aspekte chemischer Reaktionen wie chemisches Gleichgewicht und Aktivierungsenergie zu verstehen und Katalyseprozesse zu untersuchen. Letzteres macht es in mehreren Anwendungen besonders wichtig, von Biochemie bis hin zu Industrie -Engineering.
In der Mitte der Kinetik ist die Reaktionsgeschwindigkeit, die als die Geschwindigkeit verstanden werden kann, mit der die Reagenzien in Produkte umgewandelt werden. In der chemischen Kinetik gibt es jedoch eine viel genauere Definition.
Definition der Reaktionsgeschwindigkeit
Beginnen wir mit der folgenden generischen chemischen Reaktion, um die vollständige Definition der Reaktionsgeschwindigkeit zu geben, die in der chemischen Kinetik verwendet wird:
In dieser Reaktion repräsentieren A und B die Reagenzien, C und D repräsentieren Produkte A, b, c Und D Sie repräsentieren die jeweiligen stöchiometrischen Koeffizienten.
Die Reaktionsgeschwindigkeit (dargestellt mit dem Symbol v) Zeigt an, wie schnell. Mathematisch wird dies wie folgt ausgedrückt:
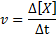
Wobei δ [x] die Änderung der molaren Konzentration der Spezies x (a, b, c oder d) im Zeitintervall ΔT darstellt.
Es ist offensichtlich, dass umso schneller die anderen Reagenzien konsumiert werden, je schneller eines der Reagenzien konsumiert werden, und je schneller die Produkte auftreten werden. Aus diesem Grund ist es nur notwendig, die Geschwindigkeit in Bezug auf einen von ihnen zu definieren.
Es kann Ihnen dienen: Methoden zur Trennung homogener GemischeUm sicherzustellen, dass das Ergebnis der Berechnung der Geschwindigkeit immer gleich ist, unabhängig davon, welche Spezies die Geschwindigkeit definiert ist. Das heißt:
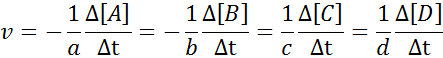
Beispiel für die Definition der Reaktionsgeschwindigkeit
Angesichts der folgenden chemischen Reaktion:
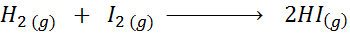
Schreiben Sie die Definition der Reaktionsgeschwindigkeit in Abhängigkeit von jeder beteiligten Art.
Lösung:
In Bezug auf h2:
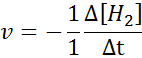
In Bezug auf i2:
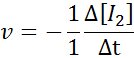
In Bezug auf HI:
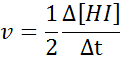
Das Geschwindigkeitsgesetz und die Reaktionsordnung
Reaktionen treten auf, wenn Atome und Moleküle mit ausreichender Energie und richtiger Ausrichtung miteinander kollidieren. Die Wahrscheinlichkeit, dass dies geschieht, nimmt zu, wenn Atome und Moleküle stärker konzentriert sind.
Aus diesem Grund hängt die Geschwindigkeit fast immer von der Konzentration von Reagenzien ab. In einigen Fällen hängt die Geschwindigkeit auch von der Konzentration eines der Produkte sowie von der Konzentration eines Katalysators oder Inhibitors ab, der in der Umwelt vorhanden ist.
Die mathematische Gleichung, die die Geschwindigkeit einer Reaktion auf die Konzentration der verschiedenen beteiligten Arten bezieht, heißt "GeschwindigkeitsgesetzUnd in einfacheren Fällen hat es die folgende Form:
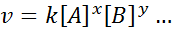
Wo k Es ist eine Verhältnismäßigkeitskonstante genannt Geschwindigkeitskonstante, und die Exponenten von A, B und allen anderen Arten, die in der Gleichung auftreten, werden genannt Reaktionsordnungen.
Gemäß der Summe aller Reaktionsordnungen (die als globale Ordnung bezeichnet werden) können verschiedene Arten von Reaktionen unterschieden werden. Diese unterschieden ).
-
Bestellreaktionen 0
Wenn alle Exponenten im Geschwindigkeitsgesetz 0 sind, wird die Gleichung des Geschwindigkeitsgesetzes auf:
Kann Ihnen dienen: kovalenter kovalenter Link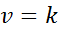
Mit anderen Worten, es sind Reaktionen, die bei konstanter Geschwindigkeit auftreten und bei denen die Geschwindigkeit nicht von der Konzentration eines Reagenzien oder Produkts abhängt.
Bestellgraphen 0
Das Diagramm von [a] gegen t der Ordnungreaktionen 0 steigen gerade Linien ab.
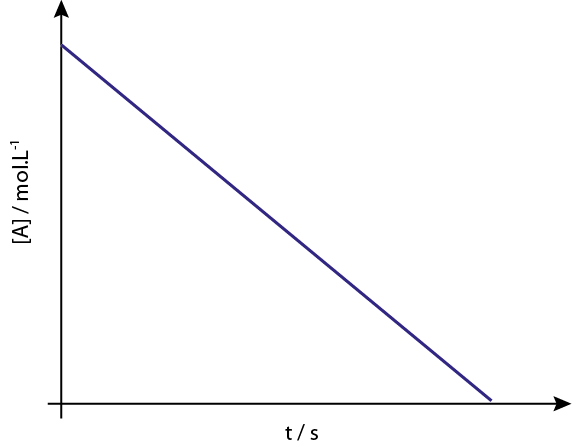
Legende: Das Konzentrationsdiagramm gegen Zeit einer Reaktion der Ordnung 0 ergibt eine gerade Linie.
Mittelleben für Ordnung 0
Für eine Reaktion der Ordnung 0 die halbe Lebenszeit (T1/2) Wird gegeben durch:
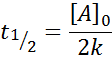
-
Reaktionen der 1. Ordnung
In diesen Reaktionen variiert die Geschwindigkeit linear mit der Konzentration. Das Geschwindigkeitsgesetz erster Ordnung lautet:
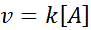
Grafik erster Ordnung
Das Diagramm von [a] gegen t der ersten Bestellungsreaktionen steigen Hyperbolas ab. Wenn jedoch der neperianische Logarithmus der Konzentration (ln [a]) gegenüber der Zeit ein Diagramm ist, wird eine gerade Linie erhalten.
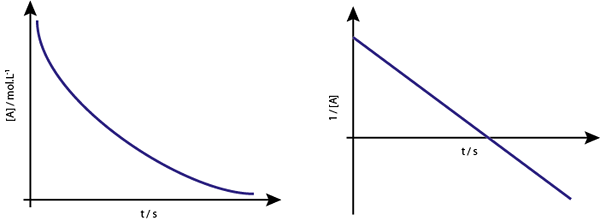 Das Konzentrationsdiagramm gegen Zeit einer Reaktion der Ordnung 1 ergibt eine Hyperbel
Das Konzentrationsdiagramm gegen Zeit einer Reaktion der Ordnung 1 ergibt eine Hyperbel Mittelleben für erste Reaktionen für den ersten Bestellen
Für eine Reaktion der Ordnung 1, T1/2 Es hängt nicht von der anfänglichen Konzentration ab und wird gegeben durch:
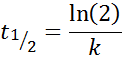
-
Reaktionen zweiter Ordnung
Eine Reaktion kann in Bezug auf ein einzelnes Reagenz oder Erste Ordnung in Bezug auf zwei Reagenzien erster Ordnung sein. Im ersten Fall wird das Geschwindigkeitsgesetz gegeben durch:
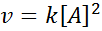
Grafik zweiter Ordnung
Das Diagramm von [a] gegen t der zweiten Orderreaktionen steigen Hyperbolas ab. Wenn jedoch die Umkehrung der Konzentration (1/[A]) gegenüber der Zeit aufgetragen wird, wird eine gerade Linie erhalten.
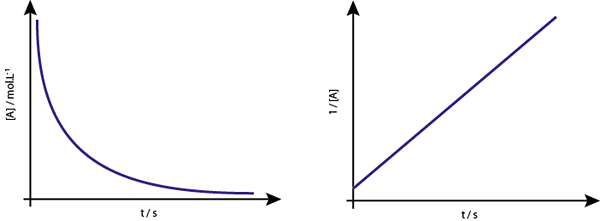 Das Konzentrationsdiagramm gegen Zeit einer Reaktion der Ordnung 2 ergibt eine Kurve, die einer absteigenden Hyperbel ähnlich ist, aber der Diagramm der Konzentration vs. Zeit ergibt eine Linie
Das Konzentrationsdiagramm gegen Zeit einer Reaktion der Ordnung 2 ergibt eine Kurve, die einer absteigenden Hyperbel ähnlich ist, aber der Diagramm der Konzentration vs. Zeit ergibt eine Linie Mittelleben für Reaktionen zweiter Ordnung
Für eine Reaktion der Ordnung 2, T1/2 Wird gegeben durch:
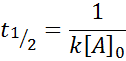
Faktoren, die die Reaktionsgeschwindigkeit beeinflussen
Temperatur
Die Temperatur erhöht immer die Geschwindigkeit, mit der die Reaktionen auftreten, da die Frequenz und Energie, mit der die Moleküle miteinander kollidieren. Die Abhängigkeit von der Reaktionsgeschwindigkeit mit der Temperatur wird durch die Arrhenius -Gleichung angegeben.
Es kann Ihnen dienen: Magnesiumhydrid: Struktur, Eigenschaften und VerwendungDruck
Zunehmender Druck entspricht der Erhöhung der Konzentration aller Spezies im Reaktionsmedium (für Gasphasenreaktionen).
Katalysatoren
Katalysatoren sind chemische Substanzen, die dem Medium zugesetzt werden, um die Reaktionsgeschwindigkeit zu erhöhen. Die meisten Katalysatoren verändern den Reaktionsmechanismus um einen, der eine geringere Aktivierungsenergie erfordert.
Häufige Katalysatorbeispiele sind Enzyme in lebenden Systemen und einigen Metallen wie Platin und Paladium.
Inhibitoren
Inhibitoren sind das Gegenteil von Katalysatoren. Sie sind Substanzen, die Reaktionen langsamer machen. Antikorrosiv sind Beispiele für Inhibitoren, die versuchen, die Geschwindigkeit von Korrosionsreaktionen zu verringern, Metalloberflächen mehr zu machen.


