Was ist chemische Periodizität?
- 1722
- 414
- Joy Hort
Der Chemische Periodizität Es ist ein Trend oder Muster, das die chemischen Elemente für einen Satz ihrer chemischen und physikalischen Eigenschaften aufweist. Es wird zu einer Art Verwandtschaft, die ein grundlegender Leitfaden für Chemie -Eltern war.
Die 118 vorhandenen Elemente (zwischen natürlicher und künstlich) halten unterschiedlich eine Beziehung zueinander, die sie in Familien oder Gruppen definiert. Zuerst erlaubte dies, die Reaktivitäten der Elemente sowie die Art von Verbindungen zu beschreiben, die sich bilden; Und noch besser die Eigenschaften derer, die noch nicht entdeckt worden waren.
 Die Elemente des Periodenzüchtertabels
Die Elemente des Periodenzüchtertabels Während des 20. Jahrhunderts und der Physik wurden diese Eigenschaften mit der elektronischen Struktur des Atoms korreliert. Daher markieren Elektronen die chemische Periodizität in Bezug auf die Elemente, aber nicht so viel für ihre Isotope und die relative Stabilität.
Dank der chemischen Periodizität ist es möglich zu verstehen. Es ermöglicht auch die Vorhersage chemischer Eigenschaften und sogar physikalischer Elemente verschiedener Atommassen.
[TOC]
Muster und Gruppen
 Wie die Zickzackmuster dieser Wolken zeigen die Eigenschaften der Elemente eine periodische und charakteristische Tendenz. Quelle: Pravin Bagga/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)
Wie die Zickzackmuster dieser Wolken zeigen die Eigenschaften der Elemente eine periodische und charakteristische Tendenz. Quelle: Pravin Bagga/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0) Die chemische Periodizität wird wie erwartet in regelmäßigen Eigenschaften beobachtet. Diese sind durch die Tendenz ihrer Werte gekennzeichnet, wie sie über einen periodischen Zeitraum oder eine Gruppe bewertet werden.
Ein Zickzack, eine Säge oder ein steiler Berg kann zu Vergleichszwecken ausgewählt werden: mit Höhen und Tiefen. Das heißt, periodische Eigenschaften haben für bestimmte Elemente minimal und maximal maximal. Und die relativen Positionen dieser Elemente entsprechen brillant mit dem Ort in ihren jeweiligen Gruppen.
Aus diesem Grund ist die chemische Periodizität nützlich, um sie auf der Grundlage von Gruppen zu analysieren. Perioden sind jedoch für eine vollständige Vision des Trends unerlässlich.
Kann Ihnen dienen: Kaliumcarbonat (K2CO3): Struktur, Eigenschaften, Verwendungen, erhaltenEs wird anhand der folgenden Beispiele für Periodizität in der Chemie gesehen, die nicht nur an den regelmäßigen Eigenschaften, sondern auch in den anorganischen Verbindungen und inklusiven organischen Angehörigen gewinnt.
Ionisationsenergie
Ionisierungsenergie ist eine der herausragendsten periodischen Eigenschaften. Je größer das Atom eines Elements ist, desto leichter wird eine seiner letzten Elektronen entfernen. Das heißt, die von Valencia. Deshalb: Atome mit kleinen Funkgeräten haben große, während Atome mit großen Funkgeräten klein sind.
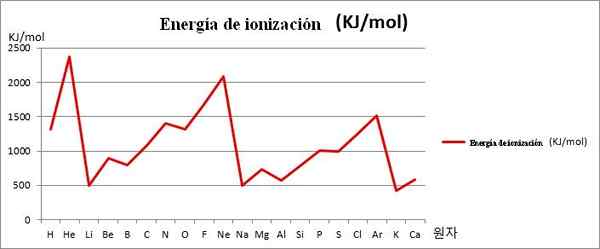 Ei gegen Grafiken. Die ersten 20 chemischen Elemente. Quelle: Kenneth.Jh.Han/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0)
Ei gegen Grafiken. Die ersten 20 chemischen Elemente. Quelle: Kenneth.Jh.Han/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0) Beachten Sie zum Beispiel im Bild oben, dass die Elemente Li, Na und K die Minderjährige EI haben, weshalb sie sich in den Tälern oder Geldern der Grafik befinden. In der Zwischenzeit befinden sich die Elemente, die er, NE und AR, auf den Gipfeln oder höheren Punkten gefunden werden, da ihre IS in Bezug auf die anderen Elemente sehr groß sind.
Die Elemente Li, Na und K gehören zur Gruppe alkalischer Metalle, die durch ihre EI -Opfer gekennzeichnet sind. Andererseits entsprechen die Elemente, die er, NE und AR den edlen Gasen mit sehr hoher entsprechen, da ihre Atome unter allen Elementen für den gleichen Zeitraum der Periodenkabine die kleinsten sind.
Daher weist die chemische Periodizität darauf hin, dass sie eine Gruppe abnimmt, aber die Reise eines Zeitraums von links nach rechts erhöht.
Blockhydros P
Ein Beispiel für die chemische Periodizität außerhalb der regelmäßigen Eigenschaften, die wir in den Hydrors der Blockelemente sehen P.
Zum Beispiel besteht Gruppe 15 aus Elementen N, P, AS, SB und BI. Wenn bekannt ist, dass das Ammoniak, NH3, Es hat den Stickstoff mit einer Oxidationszahl von +3, dann ist es möglich, durch einfache Periodizität zu erwarten, dass die verbleibenden Elemente auch ähnliche Hydros haben. Und in der Tat ist es: NH3, PH3, Asche3, Sbh3 und Bih3.
Kann Ihnen dienen: Boron: Geschichte, Eigenschaften, Struktur, verwendetEin weiterer ähnlicher Fall tritt bei Gruppe 16 auf. Sauerstoffhydrid ist h2Oder Wasser. Es wird wiederum erwartet. Und das ist: h2Sch2Se, h2Te und h2Po. Dies ist auf die chemische Periodizität zurückzuführen.
Das vielleicht beeindruckendste Beispiel wird durch Kohlenstoff-, Silizium- und Germanium -Hydros verstanden. Kohlenstoffhydrid ist Cho4, Und das von Silicon, Sih4. Das von Mendeleev mit dem Namen Eka-silicio (ES) vorhergesagte Germanio muss als Periodizität ein Hydrid mit GEH-Formel haben4; Vorhersage, die nach seiner Entdeckung und nachfolgenden Studien bestätigt wurde.
Halogenmoleküle
Wenn bekannt ist, dass Fluorid als M -Molekül im elementaren Zustand ist2, Dann wird angenommen, dass die anderen Halogene (Cl, Br, I und AT) ebenfalls Diatommoleküle bilden. Und das ist, die CL -Moleküle zu sein2, Br2 und ich2 Der bekannteste.
Oxide und Sulfide
Ähnlich wie bei Blockhydrors erwähnt P, Oxide und Sulfide für Elemente derselben Gruppe zeigen eine Art Korrespondenz in ihren jeweiligen chemischen Formeln. Zum Beispiel ist Lithiumoxid li2Oder Oxide für andere alkalische Metalle oder Gruppe 1: na sein2OKAY2Oder rb2O und CS2ENTWEDER.
Dies liegt daran, dass in allen Metallen die Metalle mit einer Oxidationszahl von +1, die mit einem Anion interagiert oder2-. Das gleiche passiert mit ihren Sulfiden: li2S, Na2S usw. Im Falle von Alkalinotherrous -Metallen oder Gruppe 2 sind die Formeln ihrer Oxide und Sulfide: Bee und BES, Mgo und Mgs, Cao und Cas, SRS und SRS, Bao und Bas.
Es kann Ihnen dienen: Selenarsäure (H2SO3): Eigenschaften, Risiken und VerwendungDiese Periodizität gilt auch (teilweise) für die Oxide der Blockelemente P: Co2, Siio2, Geo2, B2ENTWEDER3, Zum2ENTWEDER3, Ga2ENTWEDER3, usw. Für Blockelemente jedoch D oder andere des Blocks P, Diese Periodizität wird aufgrund der höchstmöglichen Oxidationszahlen für dasselbe Element komplizierter.
Zum Beispiel gehören Kupfer und Silber zur Gruppe 11. Einer hat zwei Oxide: Cuo (cu2+) und cu2Oder (cu+); Während der andere kaum nur eines hat: vor (Ag+).
Kohlenwasserstoffe und Silane
Sowohl Kohlenstoff als auch Silizium haben die Fähigkeit, C-C- oder Si-Si-Bindungen zu bilden. C-C-Bindungen sind viel stabiler, so.
Diese Schlussfolgerung ist erneut auf die chemische Periodizität zurückzuführen. Zum Beispiel Ethane, Cho3CH3 oder c2H6 Das Dissilanum hat sein Gegenstück SIH3Ja h3 oder wenn2H6.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Helmestine, Anne Marie, ph.D. (26. August 2020). Periody -Definition in der Chemie. Erholt von: thoughtco.com
- UND. V. Babaev & Ray Hefferlin. (S.F.). Konzept der chemischen Periodizität:
Aus Mendeleev molekulare Tabelle Hyper-Periodizitätsmuster. Erholt von: Chem.MSU.Ru - Blumen p., Theopold k., & Langley r. (S.F.). Periody. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Die offene Universität. (2020). Chemische Muster sind in der Perioden Tabelle zu finden: Chemische Periodizität. Erholt von: offen.Edu
- « Stabiles Gleichgewichtskonzept und Beispiele
- Geschichte der ländlichen Soziologie, Studiengebiet, Bedeutung »

