Was ist ein isothermer Prozess? (Beispiele, Übungen)

- 3497
- 909
- Luca Holdt
Er isothermaler Prozess oder Isotherme ist ein reversibler thermodynamischer Prozess, bei dem die Temperatur konstant bleibt. In einem Gas gibt es Situationen, in denen eine Änderung des Systems keine Temperaturschwankungen, sondern die physikalischen Eigenschaften erzeugt.
Diese Veränderungen sind Phasenänderungen, wenn sich der Substanz von fest zu flüssig, von Gasflüssigkeit ändert oder umgekehrt. In solchen Fällen stellen Substanzmoleküle ihre Position neu an, addieren oder extrahieren thermische Energie.
 Abbildung 1. Die Carambans, die schmelzen, sind ein Beispiel für einen isothermen Prozess. Quelle: Pixabay.
Abbildung 1. Die Carambans, die schmelzen, sind ein Beispiel für einen isothermen Prozess. Quelle: Pixabay. Die thermische Energie, die für eine Phasenänderung in einer Substanz erforderlich ist, wird als latente Wärme- oder Transformationswärme bezeichnet.
Eine Möglichkeit, einen isothermen Prozess zu erhalten. Auf diese Weise tritt ein so langsamer Wärmeaustausch auf, dass die Temperatur konstant bleibt.
Diese Arten von Prozessen werden in der Natur häufig verabreicht. Zum Beispiel beim Menschen, wenn die Körpertemperatur zunimmt oder absteigt. Dies gilt für heißes Blut im Allgemeinen.
Andere Beispiele sind das von Eis, das vor der Feder- und Eiswürfel mit Hitze schmilzt.
[TOC]
Beispiele für isotherme Prozesse
-Der Stoffwechsel mit heiß -blutigem Tieren wird bei konstanter Temperatur durchgeführt.
 Figur 2. Heiß -blutige Tiere haben Mechanismen, um die Temperatur konstant zu halten. Quelle: Wikimedia Commons.
Figur 2. Heiß -blutige Tiere haben Mechanismen, um die Temperatur konstant zu halten. Quelle: Wikimedia Commons. -Wenn das Wasser kocht, tritt eine Phasenänderung aus Gasflüssigkeit auf, und die Temperatur bleibt bei ungefähr 100 ° C konstant, da andere Faktoren den Wert beeinflussen können.
-Das Eis, das schmilzt, ist ein weiterer häufiger isothermal.
Kann Ihnen dienen: Geometrische Optik: Welche Studien, Gesetze, Anwendungen, Übungen-Automobilmotoren, Kühlschränke sowie viele andere Arten von Maschinen arbeiten korrekt in einem bestimmten Temperaturbereich. Um die entsprechende Temperatur aufrechtzuerhalten, nannten Geräte Thermostate. In seiner Gestaltung werden verschiedene Betriebsprinzipien verwendet.
Carnots Zyklus
Ein Carnot -Motor ist eine ideale Maschine, aus der die Arbeiten dank völlig reversibler Prozesse erhalten werden. Es ist eine ideale Maschine, weil es keine Prozesse betrachtet.
Der Carnot -Zyklus besteht aus vier Stadien, von denen zwei genau isotherme und die anderen beiden adiabatisch sind. Die isothermen Stadien sind Komprimierung und Erweiterung eines Gases, das für die Erzeugung der nützlichen Arbeit verantwortlich ist.
Ein Automotor arbeitet mit ähnlichen Prinzipien. Die Bewegung eines Kolbens im Zylinder wird auf andere Teile des Autos übertragen und erzeugt Bewegung. Es hat nicht das Verhalten eines idealen Systems wie dem Carnot -Motor, aber die thermodynamischen Prinzipien sind häufig.
Berechnung der Arbeiten in einem isothermen Prozess
Um die Arbeit eines Systems zu berechnen, wenn die Temperatur konstant ist, muss das erste Thermodynamikgesetz verwendet werden, was heißt:
ΔU = q - w
Dies ist eine weitere Möglichkeit, die Energieerhaltung im System auszudrücken, die durch präsentiert werden ΔU oder Energieveränderung, Q Als die Wärme geliefert und schließlich W, Welches ist die Arbeit, die das System erledigt hat.
Angenommen, das fragliche System ist ein ideales Gas, das im Zylinder eines kolorierten Kolbens enthalten ist ZU, Was funktioniert, wenn sein Volumen? V Änderung von V1 Zu V2.
 Figur 3. In einem isothermen Prozess dehnt sich das Gas im Kolben aus, ohne die Temperatur zu ändern. Quelle: YouTube.
Figur 3. In einem isothermen Prozess dehnt sich das Gas im Kolben aus, ohne die Temperatur zu ändern. Quelle: YouTube. Die ideale Gasstatusgleichung ist Pv = nrt, Das bezieht das Volumen auf den Druck P und die Temperatur T. Die Werte von N und R sind konstant: N ist die Anzahl der Mol des Gases und R der Gaskonstante. Im Falle eines isothermen Prozesss das Produkt Pv Es ist konstant.
Kann Ihnen dienen: Antoine Constanten: Formeln, Gleichungen, BeispieleNun, die geleistete Arbeit wird durch Integration einer kleinen Differenzarbeit berechnet, in der eine Kraft eine Kraft integriert F erzeugt eine kleine DX -Verschiebung:
Dw = fdx = padx
Als ADX ist genau die Variation des Volumens Dv, So:
DW = PDV
Um die gesamte Arbeit in einem isothermen Prozess zu erhalten, ist der Ausdruck von DW integriert:
Der Druck P und das Volumen V Sie sind Grafiken in einem Diagramm P-V Wie die in der Abbildung und die geleistete Arbeiten dem Bereich unter der Kurve entspricht:
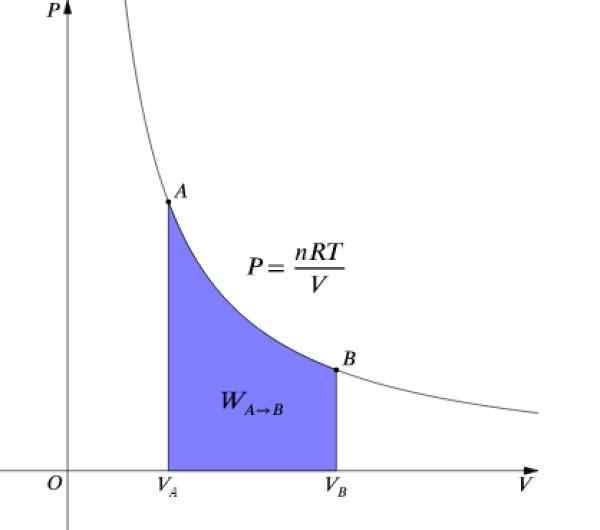 Figur 4. P-V-Diagramm eines isothermen Prozesses. Quelle: Wikimedia Commons.
Figur 4. P-V-Diagramm eines isothermen Prozesses. Quelle: Wikimedia Commons. Als ΔU = 0 Da die Temperatur konstant bleibt, muss sie in einem isothermen Prozess:
Q = w
- Übung 1
Ein mit einem mobiler Kolben versehener Zylinder enthält ein ideales Gas bei 127 ° C. Wenn sich der Kolben bewegt, bis das anfängliche Volumen um das 10 -fache reduziert ist und die Temperatur konstant hält, finden Sie die Menge der im Zylinder enthalten.180 J.
Tatsache: R = 8.3 j/mol. K
Lösung
Die Aussage bestätigt, dass die Temperatur konstant bleibt, dann befinden wir uns in Gegenwart eines isothermen Prozesses. Für die Arbeiten am Gas haben Sie die zuvor abgezogene Gleichung:

127 º C = 127 + 273 k = 400 K
N klar, die Anzahl der Maulwürfe:
N = w / rt ln (v2 / v1) = -38180 j / 8.3 j/mol.K x 400 k x ln (v2/10V2) = 5 Maulwürfe
Ein negatives Zeichen war vor der Arbeit. Der aufmerksame Leser wird im vorhergehenden Abschnitt bemerkt haben, dass W als "die Arbeit des Systems" definiert wurde und ein Zeichen hat +. Die "Arbeit am System" hat also ein negatives Zeichen.
Es kann Ihnen dienen: Zweiter Gleichgewichtsbedingung: Erklärung, Beispiele, Übungen- Übung 2
Sie haben Luft in einem Zylinder mit einem Kolben. Anfangs gibt es 0.4 m3 Druck bei 100 kPa und 80 ° C Temperatur. Die Luft wird bei 0 komprimiert.1 m3 Stellen Sie sicher, dass die Temperatur im Zylinder während des Prozesses konstant bleibt.
Bestimmen Sie, wie viel Arbeit während dieses Prozesses geleistet wird.
Lösung
Wir verwenden die Gleichung für die zuvor abgezogene Arbeit, aber die Anzahl der Maulwürfe ist unbekannt, die mit der Gleichung der idealen Gase berechnet werden kann:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = p1V1 /RT = 100000 PA x 0.4 m3 /8.3 j/mol. K x 353 k = 13.65 mol
W = n.R.T ln (v2/V1) = 13.65 mol x 8.3 j/mol. K x 353 k x ln (0.1/0.4) = -55.442.26 J
Auch hier zeigt das negative Vorzeichen an, dass die Arbeiten am System durchgeführt wurden, was immer auftritt, wenn Gas komprimiert wird.
Verweise
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 1. Mc Graw Hill.
- Cengel, und. 2012. Thermodynamik. 7ma Auflage. McGraw Hill.
- Figueroa, d. (2005). Serie: Physik für Wissenschaft und Ingenieurwesen. Band 4. Flüssigkeiten und Thermodynamik. Herausgegeben von Douglas Figueroa (USB).
- Ritter, r. 2017. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz.
- Serway, r., Vulle, c. 2011. Grundlagen der Physik. 9n / A Cengage Lernen.
- Wikipedia. Isothermaler Prozess. Abgerufen von: in.Wikipedia.Org.
- « Acrilonitrilstruktur, Eigenschaften, Produktion, verwendet
- Aufeinanderfolgende Sätze Was sind und 75 Beispiele »


