Was sind Anode und Kathode??

- 4315
- 925
- Timo Rabenstein
Er Anode und Kathode Dies sind die Arten von Elektroden in elektrochemischen Zellen. Dies sind Geräte, die durch eine chemische Reaktion Elektrizität erzeugen können. Die am häufigsten verwendeten elektrochemischen Zellen sind Batterien.
Es gibt zwei Arten von elektrochemischen Zellen, elektrolytischen Zellen und galvanischen oder voltaischen Zellen. In elektrolytischen Zellen tritt die durch Energie erzeugte chemische Reaktion nicht spontan auf, aber der elektrische Strom wird in eine chemische Oxidationsreaktion umgewandelt.

Die galvanische Zelle besteht aus zwei Semi -Sodgs. Diese sind mit zwei Elementen verbunden, einem metallischen Fahrer und einer Salzbrücke.
Der elektrische Leiter führt, wie er unter seinem Namen angezeigt wird. Die besten Treiber sind normalerweise Metalle.
Die Salzbrücke ist ein Röhrchen, das die beiden Semi -Bllads verbindet, während der elektrischen Kontakt beibehalten wird und die Komponenten jeder Zelle verbinden lassen.Jede Halbmedien der galvanischen Zelle enthält eine Elektrode und einen Elektrolyten.
Wenn die chemische Reaktion auftritt, verliert einer der Semi -Bllads durch den Oxidationsprozess Elektronen an der Elektrode; während die anderen Elektronen für die Elektrode durch den Reduktionsprozess gewinnt.
Oxidationsprozesse werden in der Anode und in den Reduktionsprozessen in der Kathode erzeugt
[TOC]
Anode
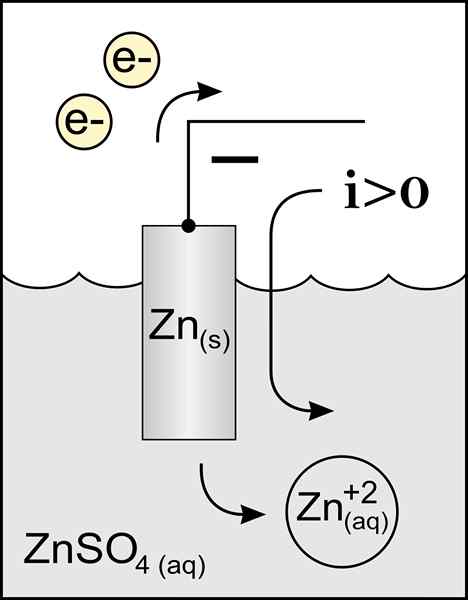 Diagramm einer Zinkanode in einer Voltaikzelle. Quelle: Originalarbeit: Datei: Zinkanode 2.PNG von Benutzer: Micheljullian (Diskussion) Derivatarbeit: KES47/CC BY-S (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/)
Diagramm einer Zinkanode in einer Voltaikzelle. Quelle: Originalarbeit: Datei: Zinkanode 2.PNG von Benutzer: Micheljullian (Diskussion) Derivatarbeit: KES47/CC BY-S (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/) Der Name der Anode stammt aus dem griechischen ανά (aná): up und οδiesen (Odós): Pfad. Faraday war derjenige, der diesen Begriff im neunzehnten Jahrhundert geprägt hatte.
Die beste Definitionsanode ist die Elektrode, die Elektronen bei einer Oxidationsreaktion verliert. Normalerweise ist es mit dem positiven Pol des Transits des elektrischen Stroms verbunden, ist aber nicht immer der Fall.
Kann Ihnen dienen: geschätzte LösungenObwohl in den Batterien der Anode der positive Pol ist, ist es in den LED -Leuchten das Gegenteil, wobei die Anode der negative Pol ist.
Normalerweise wird das Gefühl des elektrischen Stroms definiert und schätzt ihn als Gefühl freier Lasten. Wenn der Fahrer jedoch nicht metallisch ist, werden die erzeugten positiven Ladungen auf den externen Treiber übertragen.
Diese Bewegung impliziert, dass wir positive und negative Ladungen haben, die sich in entgegengesetzten Sinnen bewegen. Daher wird gesagt, dass die Richtung des Strom Anoden, die in der Kathode gefunden werden.
In galvanischen Zellen mit einem metallischen Leiter folgt der in der Reaktion erzeugte Strom den Weg vom positiven Pol zum Negativ.
Aber in Elektrolytzellen, die keinen metallischen Leiter haben, aber ein Elektrolyt, Ionen mit positiver und negativer Belastung, die sich in entgegengesetzten Sinnen bewegen.
Thermoionische Anoden empfangen die meisten Elektronen, die aus der Kathode stammen, die Anode erhitzen und einen Weg finden, sich zu lösen. Diese Wärme wird in der Spannung erzeugt, die zwischen den Elektronen auftritt.
Spezielle Anoden
Es gibt eine Art spezielle Anoden, wie z. B. die innerhalb von x -Strahlen. In diesen Röhren erzeugt die von Elektronen erzeugte Energie zusätzlich zur Erzeugung von X -Strahlen große Energie, die die Anode erhitzt.
Diese Wärme tritt bei der unterschiedlichen Spannung zwischen beiden Elektroden auf und wirkt den Elektronen Druck aus. Wenn sich die Elektronen im elektrischen Strom bewegen, trafen sie die Anode, indem sie ihre Wärme übertragen.
Kann Ihnen dienen: Henderson-Haselbalch-Gleichung: Erklärung, Beispiele, ÜbungKathode
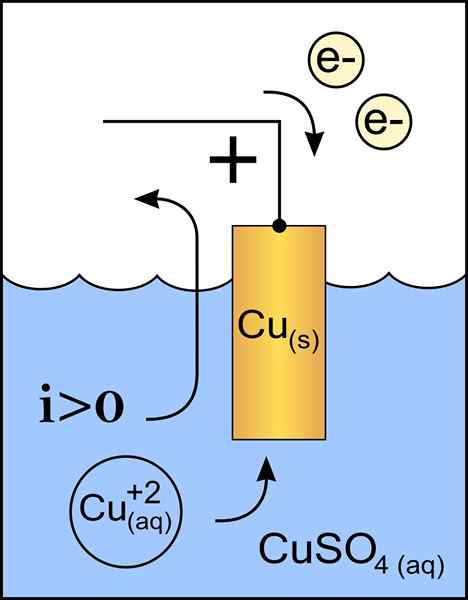 Kupferkathodendiagramm in einer Voltaikzelle. Quelle: Originalarbeit: Datei: Zinkanode 2.PNG von Benutzer: Micheljullian (Diskussion) Derivatarbeit: KES47/CC BY-S (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/)
Kupferkathodendiagramm in einer Voltaikzelle. Quelle: Originalarbeit: Datei: Zinkanode 2.PNG von Benutzer: Micheljullian (Diskussion) Derivatarbeit: KES47/CC BY-S (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/) Die Kathode ist die Elektrode mit negativer Belastung, die in der chemischen Reaktion eine Reduktionsreaktion erleidet, bei der ihr Oxidationsstatus reduziert wird, wenn sie Elektronen erhält.
Wie bei der Anode war es Faraday, der den Begriff Kathode vorschlug, der aus dem griechischen κατά [Catá] stammt: 'Down' und ὁδwor [Odós]: 'Road' '. Auf diese Elektrode wurde die negative Last im Laufe der Zeit zugeschrieben.
Dieser Ansatz war falsch, da es abhängig vom Gerät, in dem es sich befindet.
Diese Beziehung mit dem negativen Pol ergibt sich wie bei der Anode aus der Annahme, dass der Strom vom positiven Pol zum Negativ fließt. Dies entsteht in einer galvanischen Zelle.
Innerhalb der Elektrolytzellen kann das Mittel zur Energieübertragung, da sie sich nicht in einem Metall befindet, sondern in einem Elektrolyten, negative und positive Ionen koexistieren, die sich in entgegengesetzten Sinnen bewegen. Aber nach Vereinbarung wird gesagt, dass der Strom von der Anode zur Kathode geht.
Spezielle Kathoden
Eine Art spezifische Kathoden sind thermionische Kathoden. In diesen emittiert die Kathode aufgrund der Auswirkung von Wärme Elektronen.
In thermionischen Ventilen kann die Kathode sich erhitzen, indem er einen Heizstrom in einem Filament zirkuliert.
Gleichgewichtsreaktion
Wenn wir eine galvanische Zelle nehmen, die die häufigste elektrochemische Zelle ist, können wir die erzeugte Gleichgewichtsreaktion formulieren.
Jede Halbmedien, die die galvanische Zelle bildet, hat eine charakteristische Spannung, die als Reduktionspotential bekannt ist. Innerhalb jeder Semi -Media gibt es eine Oxidationsreaktion zwischen den verschiedenen Ionen.
Kann Ihnen dienen: AbsorptionsspektrumWenn diese Reaktion ein Gleichgewicht erreicht, kann die Zelle nicht mehr Spannungen liefern. Zu diesem Zeitpunkt hat die Oxidation, die in der Halbmedien in diesem Moment stattfindet. Das Potenzial der Reaktion wird umso höher sein, je mehr das Gleichgewicht erreicht ist.
Wenn die Anode im Gleichgewicht ist, verliert er Elektronen, die durch den Fahrer zur Kathode gehen.
In der Kathode findet die Reduktionsreaktion statt.
Verweise
- Huhey, James und., et al.Anorganische Chemie: Grundsätze der Struktur und Reaktivität. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Chemie: Grundsätze und Eigenschaften. New York, USA: McGraw-Hill, 1966.
- Brady, James und.Allgemeine Chemie: Grundsätze und Struktur. Wiley, 1990.
- Petrucci, Ralph H., et al.Allgemeine Chemie. Inter -American Educational Fund, 1977.
- Masterton, William L.; Hurley, Cecile n.Chemie: Prinzipien und Reaktionen. Cengage Learning, 2015.
- Charlot, Gaston; Tremillon, Bernard; Badoz-Lambling, J. Elektrochemische Reaktionen. Toray-Masson, 1969.
- « Die 10 wichtigsten Beiträge und Erfindungen
- Quetzal -Eigenschaften, Lebensraum, Reproduktion, Lebensmittel »

