Keratin -Typen, Struktur, Ort und Funktionen
- 4472
- 1043
- Lewis Holzner
Der Keratin Es handelt. Es hat sehr unterschiedliche Formen und ist chemisch wenig reaktiv.
Seine Struktur wurde erstmals 1951 von den Wissenschaftlern Linus Pauling und Robert Corey beschrieben, während die Tierhaarstruktur analysiert wurde. Diese Forscher gaben auch Hinweise auf die Struktur des Myosins des Muskelgewebes
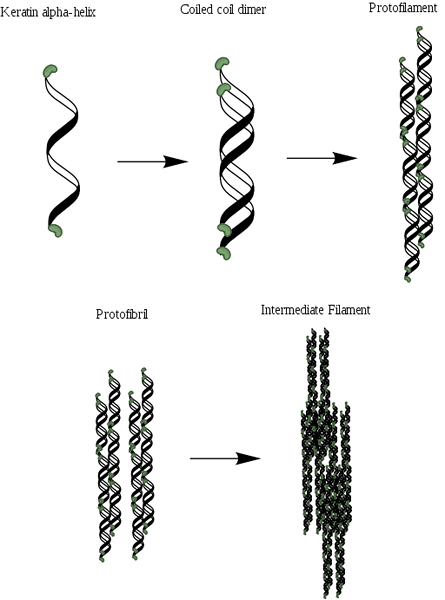
 Alfa-Queratin-Organisationsschema (Quelle: MLPatton [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Alfa-Queratin-Organisationsschema (Quelle: MLPatton [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Nach dem Kollagen ist es eines der wichtigsten Proteine von Tieren und repräsentiert den größten Teil des Trockengewichts des Haares, der Wolle, der Nägel, Krallen und Hufe, Federn, Hörner und einem wesentlichen Teil der äußeren Schicht der Haut.
Die "keratinisierten" Elemente von Tieren können sehr unterschiedliche Morphologien haben, die weitgehend von der Funktion abhängen, die sie in jedem bestimmten Organismus ausüben.
Keratin ist ein Protein, das Eigenschaften aufweist, die ihm eine große mechanische Effizienz in Bezug auf Spannung und Komprimierung verleihen. Es wird von einer speziellen Art von Zellen produziert, die als "Keratinozyten" bezeichnet werden, die normalerweise sterben, nachdem sie sie produziert haben.
Einige Autoren bestätigen, dass Keratine in einem Stoff- und Stadium -Stadion ausgedrückt werden. Beim Menschen gibt es mehr als 30 kodierende Gene für diese Proteine, und diese gehören zu einer Familie, die sich für mehrere Runden genetischer Duplikation entwickelt hat.
[TOC]
Arten von Keratinen und ihre Struktur
Es gibt im Wesentlichen zwei Arten von Keratinen: α und β. Diese unterscheiden sich durch Besitz einer Grundstruktur, die hauptsächlich aus Polypeptidketten besteht, die als Alpha-Propeller (α-Queratinas) aufgenommen werden können oder parallel als mit β-geschickte Blätter (β-Chap) zusammengeschlossen werden (β-Chap) (β-Cheap), die sich parallel zusammenschließen können (β-Cha-Schloss).
α-Queratinas
Diese Art von Keratin ist am meisten untersucht und es ist bekannt, dass Säugetiere mindestens 30 verschiedene Varianten dieser Art von Keratin haben. Bei diesen Tieren sind α-das Teil von Nägeln, Haaren, Hörnern, Helmen, Spikes und Epidermis.
Wie das Kollagen enthalten diese Proteine in ihrer Struktur einen reichlich vorhandenen Anteil kleiner Aminosäuren wie Glycin und Alanin, die die Etablierung von Alpha -Propellern ermöglichen. Die molekulare Struktur eines α-Queratins besteht aus drei verschiedenen Regionen: (1) kristallinen Fibrillen oder Propellern, (2) die Enddomänen der Filamente und (3) die Matrix.
Die Propeller sind zwei und bilden ein Dimer, das einer gewickelten Spirale ähnelt, die dank der Anwesenheit von Links oder Disulfurbrücken (S-S) vereint bleibt. Jeder der Propeller hat ungefähr 3.6 Aminosäureabfälle In jeder Runde, die mehr oder weniger 310 Aminosäuren gibt und besteht.
Es kann Ihnen dienen: Flora und Fauna der Ecuadorian Sierra: Repräsentative ArtenDiese gewickelten Spiralen können dann mit einer Struktur assoziiert sein.
Protofilamente haben N- und C-Terminale nicht-helikale Enden, die reich an Cysteinresten sind und an die zentrale Region oder die Matrix gebunden sind. Diese Moleküle polymerisieren, um die Zwischenfilamente mit einem Durchmesser von fast 7 nm zu bilden.
Zwei Arten von Zwischenfilamenten aus Keratin werden unterschieden: die mittleren sauren Filamente (Typ I) und die Grundlagen (Typ II). Diese sind in eine Proteinmatrix eingebettet und die Art und Weise, wie diese Filamente geordnet werden.
In den Filamenten vom Typ I haben sich Propeller mittels drei „helikaler Stecker“ miteinander verbinden. In Filamenten vom Typ II gibt es auch zwei Subdomänen, die zu den helikalen Domänen gehören.
Beispiel einer Struktur mit α-Queratinas: Haare
Wenn die Struktur eines typischen Haares analysiert wird, hat es einen ungefähren Durchmesser von 20 Mikrometer und besteht aus toten Zellen, die enthalten sind.
 Säugetierhaare wie diese Kuh besteht aus Keratin (Quelle: Frank Winkler über Pixabay.com)
Säugetierhaare wie diese Kuh besteht aus Keratin (Quelle: Frank Winkler über Pixabay.com) Makropibrillen bestehen aus Mikrofibrillen mit weniger Durchmesser und werden durch eine amorphe Proteinsubstanz mit hohem Schwefelgehalt miteinander verbunden.
Diese Mikrofibrillen sind Gruppen kleinerer Protofibrillen mit einem 9+2 -Organisationsmuster, was bedeutet, dass neun Protofibrillas zwei zentrale Protofibrillen umgeben; Alle diese Strukturen bestehen im Wesentlichen aus α-Queratin.
Weiche Keratine und harte Keratine
Abhängig vom Schwefelgehalt können α-Queratinas als weiche Keratine oder harte Keratine klassifiziert werden. Dies hat mit der mechanischen Widerstandskraft zu tun, die durch die Disulfidverbindungen in der Proteinstruktur auferlegt wird.
In der Gruppe der harten Keratine sind diejenigen, die Teil der Haare, Hörner und Nägel sind.
Die Disulfidbindungen können durch die Anwendung eines Reduktionsmittels beseitigt werden, sodass die aus Keratin bestehenden Strukturen von Tieren nicht leicht verdaulich sind.
Es kann Ihnen dienen: Ficologyβ-Queratinas
Β-that sind viel stärker als α-Queratinas und sind in Reptilien und Vögeln als Teil der Krallen, Skalen, Federn und Peaks vorhanden. In den Geckos bestehen die in ihren Beinen (Pilzen) gefundenen Mikrovings auch aus diesem Protein.
Seine molekulare Struktur besteht aus β-gepeelten Blättern, die durch antiparallete Polypeptidketten gebildet werden, die durch Bindungen oder Wasserstoffbrücken zusammenbinden. Diese Ketten, nebeneinander, bilden kleine starre und flache Oberflächen, leicht gefaltet.
Wo bist du und was sind deine Funktionen??
Die Keratinfunktionen hängen vor allem mit der Art der Struktur und dem Ort des Körpers des Tieres zusammen, an dem es sich befindet.
Wie andere fibröse Proteine verleiht dies den Zellen Stabilität und strukturelle Steifheit, da sie zur großen Proteinfamilie gehört, die als Familie der Zwischenfilamente bekannt ist, die Proteine des Zytoskeletts sind.
In Schutz und Deckung
Die obere Hautschicht der oberen Tiere hat ein großes Netzwerk von Zwischenfilamenten, die von Keratin gebildet werden. Diese Schicht wird als Epidermis bezeichnet und hat zwischen 30 Mikrometern und 1 nm dick beim Menschen.
Die Epidermis wirkt als Schutzbarriere gegen verschiedene Arten von mechanischer und chemischer Stress und wird von einer speziellen Art von Zellen, die als "Keratinozyten" bezeichnet werden, synthetisiert.
Zusätzlich zu der Epidermis gibt es eine noch externere Schicht, die sich ständig bewegt.
Espinas und Púas werden auch von verschiedenen Tieren für ihren eigenen Schutz gegen Raubtiere und andere Aggressoren verwendet.
Die "Rüstung" der Pangoline, einige kleine insektenfressende Säugetiere, die in Asien und Afrika leben, bestehen auch aus "Skalen" von Keratin, die sie schützen.
Zu Verteidigung und anderen Funktionen
Die Hörner werden bei Tieren der Familie Bovidae beobachtet, dh bei Kühen, Schafen und Ziegen. Sie sind sehr starke und resistente Strukturen und die Tiere, die sie als Verteidigungs- und Werbeorganisationen beschäftigen lassen.
Die Hörner werden durch ein Knochenzentrum gebildet, das aus "schwammigem" Knochen besteht, der von der Haut bedeckt ist, die aus der hinteren Zone des Schädels projiziert wird.
 Nägel sind ein weiteres Beispiel für Körperteile aus Keratin (Quelle: Adobe Stock über Pixabay.com)
Nägel sind ein weiteres Beispiel für Körperteile aus Keratin (Quelle: Adobe Stock über Pixabay.com) Die Krallen und Nägel servieren zusätzlich zu ihren Funktionen in Bezug auf Lebensmittel und Unterstützung auch Tiere als "Waffen" -Ververteidigung gegen Angreifer und Raubtiere.
Kann Ihnen dienen: Fixist -Theorie: Konzept, Postulate und AutorenVogelspitzen erfüllen mehrere Zwecke, darunter unter anderem Nahrung, Verteidigung, Werbung, Wärmeaustausch und Toilette. In der Natur gibt es mehrere Sorten von Pikos in Vögeln, insbesondere in Bezug auf Form, Farbe, Größe und Stärke der damit verbundenen Kiefer.
Die Peaks sind ebenso wie die Hörner durch ein Knochenzentrum, das aus dem Schädel projiziert wird und mit resistenten β-Queratin-Blättern bedeckt ist.
Die Zähne von unglidrierten Tieren ("Ahnen" Wirbeltiere) bestehen aus Keratin und haben wie die Zähne von "überlegenen" Wirbeltieren mehrere Funktionen in Bezug auf Nahrung und Verteidigung.
In der Bewegung
Die Helme vieler Wiederkäuer und ugulierten Tiere (Pferde, Esel, Alces usw.) Sie bestehen aus Keratin, sie sind sehr resistent und schützen die Beine und arbeiten in der Bewegung zusammen.
Die Federn, die auch von Vögeln zum Bewegen verwendet werden, bestehen aus β-Chape. Diese Strukturen haben außerdem Funktionen in der Tarnung, in der Werbung, in der thermischen Isolierung und in der Undurchlässigkeit.
 Die Federn und der Gipfel der Vögel bestehen auch aus Keratin (Quelle: Couleur über Pixabay.com)
Die Federn und der Gipfel der Vögel bestehen auch aus Keratin (Quelle: Couleur über Pixabay.com) In der Industrie
Die Textilindustrie ist einer der Hauptausbeuter der keratinisierten Strukturen, anthropozentrisch gesehen. Die Wolle und das Haar vieler Tiere sind auf industrieller Ebene wichtig, da mit ihnen verschiedene Kleidungsstücke, die für Männer aus verschiedenen Sichtweisen nützlich sind.
Verweise
- Koolman, j., & Roehm, k. (2005). Atlas der biochemischen Farbe (2. Aufl.). New York, USA: Thieme.
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biochemie (3. Aufl.). San Francisco, Kalifornien: Pearson.
- Nelson, d. L., & Cox, m. M. (2009). Lehninger Prinzipien der Biochemie. Omega -Ausgaben (5. Aufl.).
- Pauling, l., & Corey, r. (1951). Die Struktur von Haaren, Muskeln und verwandten Proteinen. Chemie, 37, 261-271.
- Phillips, d., Korge, geb., & James, w. (1994). Keratin und Keratinisierung. Zeitschrift der American Academy of Dermatology, 30(1), 85-102.
- Rouse, j. G., & Dyke, m. UND. Gehen. (2010). Eine Überprüfung von Biomaterialien auf Keratin-basierten Biomaterialien für biomedizinische Anwendungen. Materialien, 3, 999-1014.
- Smith, f. J. D. (2003). Die molekulare Genetik von Keratinstörungen. Am J Clin Dermatol, 4(5), 347-364.
- Voet, d., & Voet, j. (2006). Biochemie (3. Aufl.). Pan -American Medical Editorial.
- Wang, b., Yang, w., McKitrick, j., & Meyers, m. ZU. (2016). Keratin: Struktur, mechanische Eigenschaften, Auftreten in biologischen Organismen und Bioinspirationsbemühungen. Fortschritte in der Materialwissenschaft.
- « Neues Spanien und Beziehungen zum weltweiten Hintergrund, Routen
- Wiederholungserlernungseigenschaften, Vorteile, Nachteile »

