Chimotripsin -Eigenschaften, Struktur, Funktionen, Wirkungsmechanismus
- 1329
- 322
- Frederike Birkemeyer
Der Chimotripsin Es ist das zweithäufigste Verdauungsprotein an der Bauchspeicheldrüse in Richtung des Dünndarms. Es handelt.
Der Name "Chemotripsin" vereint tatsächlich eine Gruppe von Enzymen, die von der Bauchspeicheldrüse produziert werden und die aktiv an Darmverdauungen von Proteinen bei Tieren teilnehmen. Das Wort leitet sich aus der Reninaktion ab, die dieses Enzym auf dem Magengehalt oder dem "Chimo" hat, oder der "Chimo".
 Chimotripsinstruktur (Quelle: Benutzer: Mattyjenjen [Attribution] über Wikimedia Commons)
Chimotripsinstruktur (Quelle: Benutzer: Mattyjenjen [Attribution] über Wikimedia Commons) Obwohl nicht genau bekannt ist, wie weit seine Verteilung im Tierreich ist, wird berücksichtigt, dass diese Enzyme zumindest in allen Lämmern vorhanden sind und Berichte über ihre Anwesenheit in "primitiveren Kanten" wie den Arthropoden und der von vorhanden sind Die Celestroads.
Bei den Tieren mit Bauchspeicheldrüse ist ein solches Organ die Hauptstelle der Chimotripsin -Produktion sowie andere Proteasen, enzymatische Inhibitoren und Vorläufer oder Zimogene.
Die Chimotripsine sind die am stärksten untersuchten und besser charakterisierten Enzyme, nicht nur in Bezug auf ihre Biosynthese, sondern auch mit ihrer Aktivierung von Zimogen, seinen enzymatischen Eigenschaften, seiner Hemmung, seiner kinetischen und katalytischen Eigenschaften und seiner allgemeinen Struktur.
[TOC]
Eigenschaften und Struktur
Die Chimotripsine sind Endopeptidasen, dh Proteasen, die Peptidbindungen von Aminosäuren in „inneren“ Positionen anderer Proteine hydrolysieren; Obwohl auch gezeigt wurde, dass sie Ester hydrolyzieren können ,meidas und Arilamidas, obwohl mit geringerer Selektivität.
Sie haben ein durchschnittliches Molekulargewicht von etwa 25 kDa (245 Aminosäuren) und werden aus Vorläufern hergestellt, die als Chemotripsinogene bekannt sind.
Aus der Bauchspeicheldrüse von Rindertieren wurden 2 Arten von Chemotripsinogenen gereinigt, die A und B. Im Schweinemodell wurde Chimotripsinogen C ein dritter Chemotripsinogen beschrieben. Jedes dieser drei Zimogene ist für die Herstellung von Chimotropsinen A, B und C verantwortlich.
Es kann Ihnen dienen: Quintana Roo Flora und FaunaChimotripsin A wird durch drei Polypeptidketten gebildet, die durch Brücken oder Disulfidbindungen zwischen Cysteinresten kovalent miteinander verbunden sind. Es ist jedoch wichtig zu erwähnen, dass viele Autoren es für ein monomeres Enzym betrachten (bestehend aus einer einzelnen Untereinheit).
Diese Ketten bilden eine Struktur mit einer Ellipsoidform, in der Gruppen mit elektromagnetischen Belastungen in Richtung der Oberfläche befinden (mit Ausnahme von Aminosäuren, die an katalytischen Funktionen beteiligt sind).
Im Allgemeinen sind Chimotropsine extrem aktiv für den pH -Wert der Säure, obwohl diejenigen, die aus Insekten und anderen nicht wirbeltierigen Tieren beschrieben und gereinigt wurden.
Chemotripsin -Funktionen
Wenn die exokrine Bauchspeicheldrüse stimuliert wird, sei es durch Hormone oder durch elektrische Impulse, freisetzt dieses Organ sekretorische Granulate, die reich an Chemotripsinogen sind, das einmal den Dünndarm erreicht, wird durch eine andere Protease zwischen Abfall 15 und 16 geschnitten und wird dann „auto strafrechtlich verfolgt“, um eine durchzuführen, um eine auszuführen, um eine auszuführen, um eine auszuführen vollständig aktives Protein.
Vielleicht ist die Hauptfunktion dieses Enzym.
Die Produkte einer solchen Proteolyse dienen später durch Aminosäure -Katabolismus als Kohlenstoff- und Energiequelle oder können direkt für die Bildung neuer Zellproteine „recycelt“ werden, die auf physiologischer Ebene mehrere und unterschiedliche Funktionen ausüben können.
Wirkmechanismus
Die Chimotripsine üben ihre Wirkungen erst nach Aktivierung aus, da diese als "Vorläufer" (Zimogen) -Formen erzeugt werden, die als chemotropsinogenisch bezeichnet werden.
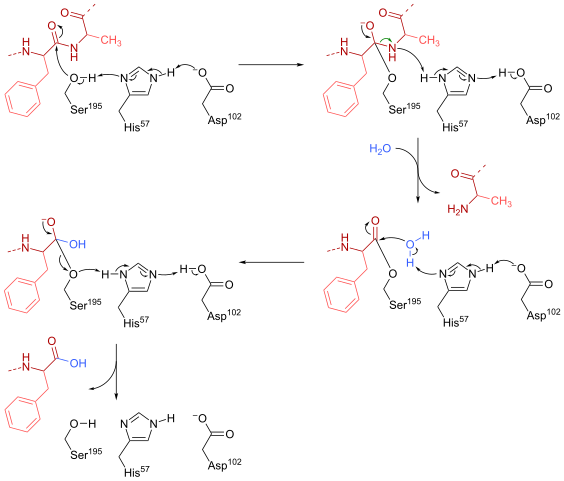 Quimotripsin -Reaktionsmechanismus (Quelle: HBF878 [CC0] über Wikimedia Commons)
Quimotripsin -Reaktionsmechanismus (Quelle: HBF878 [CC0] über Wikimedia Commons) Ausbildung
Die Zimogene von Chimotripsin werden von den Acinar -Zellen der Bauchspeicheldrüse synthetisiert, woraufhin sie vom endoplasmatischen Retikulum zum Golgi -Komplex wandern, wo sie in membranösen Komplexen oder Sekretionskörpern verpackt sind.
Kann Ihnen dienen: Wissenschaften, die sich auf die Biologie beziehenDiese Granulate akkumulieren an den Enden der Acinos und werden als Reaktion auf hormonelle Reize oder Nervenimpulse freigesetzt.
Aktivierung
Abhängig von den Aktivierungsbedingungen können jedoch verschiedene Arten von Chimotripsinen festgestellt werden.
Die Aktivierungsreaktion besteht zunächst aus der Schneidbindung zwischen Aminosäuren 15 und 16 des Chimotripsinogens, das das π-Quimotripsin bildet, das zu „Selbstverfahren“ und vollständiger Aktivierung der Autokatalyse in der Lage ist.
Die Wirkung dieses letzten Enzyms fördert die Bildung von After-Peptiden durch die C-terminale Kette, die mit Rest 149 beginnt.
Die Teile, die dem Abfall 14-15 und 147-148 (zwei Dipéptiden) entsprechen.
Katalytische Aktivität
Das Chimotripsin ist verantwortlich für die hydrolysierende Peptidbindungen und greift vorwiegend den Carboxylanteil von Aminosäuren an, die aromatische laterale Gruppen haben, dh Aminosäuren wie Tyrosin, Tryptophan und Phenylalanin.
Ein Serin (195) innerhalb des aktiven Zentrums (Gly-Asp-Serie-Gly-Glu-Ala-Val) dieser Art von Enzymen ist vielleicht der wichtigste Rest für seinen Betrieb. Der Reaktionsmechanismus ist wie folgt:
- Das Chimotripsin wird ursprünglich in einer "substratfreien" Form gefunden, in der die katalytische "Triade" aus der lateralen Carboxylgruppe eines Aspartatrests (102), dem Imidazolring eines Histidinrests (57) und der Gruppenseite Hydroxylring von besteht ein Serin (195).
- Das Substrat trifft das Enzym und bildet dies zu einem typischen Enzym-Substrat-Komplex (gemäß dem mikaelischen Modell), wobei die katalytische „Triade“ den nukleophilen Angriff erleichtert, indem er die Hydroxylgruppe des Serins von Serin aktiviert.
Es kann Ihnen dienen: Stickstoffbasen: Was sind, Klassifizierung, Funktionen- Der entscheidende Punkt des Reaktionsmechanismus besteht in der Bildung einer partiellen Verbindung, die zur Polarisation der Hydroxylgruppe führt, die ausreicht, um die Reaktion zu beschleunigen.
- Nach dem nukleophilen Angriff wird die Carboxylgruppe zu einem tetraedrischen Oxianion -Intermediär, der durch zwei Wasserstoffbrücken stabilisiert wird, die von den Gruppen N und H des Glyrestes 193 gebildet werden und 195 sind.
- Oxyanion ist spontan "neu ordnen" und ein enzymatischer Vermittler wird gebildet, zu dem eine Acylgruppe zugesetzt wurde (Acyled -Enzym).
- Die Reaktion wird mit dem Eintritt eines Wassermoleküls in das aktive Zentrum fortgesetzt, ein Molekül, das einen neuen nucleophilen Angriff fördert.
- Die Reaktion endet, wenn dieser zweite Vermittler erneut angeordnet wird und wieder den Enzym-Substrat-Micaelian-Komplex bildet, in dem das aktive Zentrum des Enzyms durch das in der Carboxylgruppe enthaltene Produkt besetzt ist.
Verweise
- Appel, w. (1986). Chymotrypsin: Molekulare und katalytische Eigenschaften. Klinische Biochemie, 19 (6), 317-3222222.
- Bender, m. L., Killheffer, j. V., & Cohen, s. (1973). Chymotrypsin. CRC Critical Reviews in Biochemistry, 1 (2), 149-199.
- Blasen, d. M. (1971). 6 Die Struktur von Chymotrypsin. In den Enzymen (vol. 3, pp. 185-212). Akademische Presse.
- Blasen, d. M. (1976). Struktur und Mechanismus von Chymotrypsin. Berichte der chemischen Forschung, 9 (4), 145-152.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Polgár, l. (2013). Katalytische Mechanismen von Serin- und Threonin -Peptiden. Im Handbuch von proteolytischen Enzymen (pp. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hypothese für den Wirkungsmechanismus von Chymotrypsin. Verfahren der Nationalen Akademie der Wissenschaften der Vereinigten Staaten von Amerika, 43 (11), 969.
- « Benzylsäuresynthese, Transposition und Verwendung
- Visuelle Lerneigenschaften, Strategien, Aktivitäten, Beispiele »

