Radikale mieten, wie sie sich bilden, Nomenklatur, Beispiele

- 4243
- 139
- Rieke Scheer
Der Radikale Miete Sie sind eine Reihe von instabilen Molekülen, die aus dem Verlust von Wasserleuten eines Alkans stammen. Sie zeichnen sich durch ein verschwundenes Elektron aus, so dass sie schnell reagieren, um das Oktett der Valencia des Atoms zu vervollständigen, in dem es sich befindet.
Diese Radikale werden mit dem Buchstaben R symbolisiert, ebenso wie die Mietgruppen, aber mit dem Unterschied, dass ein Punkt hinzugefügt wird, r ·. Dieser Punkt zeigt das Vorhandensein eines Elektrons, der verschwunden ist. Betrachten Sie zum Beispiel Methangas, Cho4. Dieses Alkan, der eines seiner Hydrogene verliert, wird in das radikale Methyl umgewandelt, Cho3· (Bild unten).
 Allgemeine Formel eines radikalen Alkyls und des radikalen Methyls. Quelle: Gabriel Bolívar über Molview.
Allgemeine Formel eines radikalen Alkyls und des radikalen Methyls. Quelle: Gabriel Bolívar über Molview. Wenn Sie sich ein wenig über die radikale Struktur vertiefen möchten CH3· Es ist zu erkennen, dass sein verschwundenes Elektron in einem Winkel senkrecht zu den C-H-Glieder liegt; Das heißt, es befindet sich in einem Orbital P rein. Daher Cho3· Übernehmen Sie eine SP -Hybridisierung2, als auch im Allgemeinen mit anderen Radikalen Alkyl.
Diese Radikale sind der Eckpfeiler der Kettenreaktionen, an denen die Alkane teilnehmen, wie dies bei ihren Halogenierungen der Fall ist: Chlorierung, Bromation usw. Es gibt die 1., 2. und 3. Radikale sowie Vinyl und Alilic, jeweils ihre jeweilige Stabilität und Leichtigkeit des Trainings.
[TOC]
Wie sind Radikale Alkyl gebildet?
Die "einfachere" Reaktion, für die Radikale gebildet werden, ist die Halogenierung der Alkane. Um zu bilden, muss die Kettenreaktion verabreicht werden, die nur bei hohen Temperaturen (über 250 ° C) oder unter der Inzidenz von ultraviolettem Licht bei Raumtemperatur auftritt.
Kann Ihnen dienen: Natriumsulfit (Na2SO3)Betrachten Sie die Chlorierung von Methan unter einer der oben genannten Bedingungen:
Cl2 → 2cl ·
Die bereitgestellte Energie reicht aus, um die CL-Cl-Verbindung des Chlormoleküls zu brechen, wobei eine homolitische Pause auftritt. Das heißt, jedes Chloratom bleibt bei einem der Verbindungselektronen. Daher werden zwei Radikale gebildet.
Dann greift ein radikaler Cl · ein Methanmolekül an:
Cl · + ch4 → HCl + CH3·
Und das radikale Methyl erscheint. Das Ch3· Es ist ziemlich instabil, so dass es sofort reagiert, um ein zusätzliches Elektron zu gewinnen, mit dem es sein einsames Elektron erscheint:
CH3· + Cl2 → Ch3Cl + Cl ·
Die gebildete wird mit einem anderen Methanmolekül reagieren und der Zyklus wird immer wieder wiederholt. Wenn das Methan abläuft, treten die folgenden Reaktionen auf, die die Kettenreaktion beenden:
Cl · + · cl → cl2
CH3· + · Cho3 → Ch3CH3
CH3· + · Cl → ch3Cl
Relative Stabilität
CH3
Methan ist nicht das einzige Alkan, das durch Chlorierung "radikalisiert" wird. Es passiert auch mit Ethan, Propan, Butan und anderen Isomern gleich. Was jedoch unterschiedlich ist. Im Falle des Methylradikals ist es sehr instabil und daher schwer zu bilden.
So die radikale Cho3CH2· Es ist stabiler und einfacher zu formen als Cho3·. Weil? Weil das radikale ch3CH2· Es ist primär, das erste, was bedeutet, dass sich das verschwundene Elektron auf einem Kohlenstoffatom befindet, das mit einem anderen Kohlenstoff verbunden ist. Inzwischen Cho3Sobald es mit Wasserstoffatomen verbunden ist.
Kann Ihnen dienen: Fluorid: Anamnese, Eigenschaften, Struktur, Erhalten, Risiken, verwendetUm was geht es hierbei? Wenn Sie sich an die vorherige Darstellung erinnern, befindet sich das verschwundene Elektron in einem Orbital P, senkrecht zu den anderen Links. In Ch3· Wasserstoffatome spenden kaum die elektronische Dichte an das Kohlenstoffatom, um das Fehlen eines anderen Elektrons auszugleichen.
1
In Ch3CH2· Andererseits ist Kohlenstoff mit dem verschwundenen Elektron mit zwei Wasserstoffen und einer Methylgruppe verbunden. Infolgedessen erhält dieser Kohlenstoff eine größere elektronische Dichte, was dazu beiträgt, dass das Elektron ein wenig verschwunden ist. Die gleiche Erklärung gilt für andere 1. Alkynd -Radikale.
2
In einem radikalen Sekundär- oder 2. Alquil, wie dem Isopropil -Radikal (CH)3)2C. Daher ist es stabiler als 1. und Methylradikale.
3
Wir haben auch Tertiär- oder 3. Alkynd-Radikale wie das Ter-Butylradikal3)3C ·. Diese sind stabiler als die 1. und 2. Jetzt gibt es drei kohlensäurehaltige Gruppen als das Wasserstoffatom, das das verschwundene Elektron stabilisiert.
Allyl- und Vinyl
Es ist auch erwähnenswert, die Allylradikalen zu erwähnen, Cho2= Ch-ch2· Und Vinyl, Cho2= Ch ·.
Alilic ist der stabilste von allen. Dies liegt daran. Der vínilico hingegen ist der instabilste von allen, seit die Cho -Gruppe2= mehr Säure, zieht die elektronische Dichte zu sich selbst an, anstatt sie für Kohlenstoff zu spenden, wobei das Elektron verschwunden ist.
Kann Ihnen dienen: Bleihydroxid: Struktur, Eigenschaften, Verwendungen, RisikenZusammenfassend lässt sich sagen, dass die relative Stabilität der Alkynd -Radikalen von höchster bis niedrigsten:
Alilo> 3rd> 2.> 1st> Vinyl
Nomenklatur
Die Nomenklatur des Radikalsalkyls ist dieselbe wie für die Remedie. So, Cho3CH2· Wird Ethylradikal genannt; und das radikale ch3CH2CH2CH3, N-Butyl.
Hauptradikale Miete
Die Hauptalkylradikale übereinstimmen mit Alkylgruppen: Sie sind diejenigen, die weniger als sechs Kohlenstoffatome haben. Daher stammen die Radikalen aus Methan, Ethan, Propan, Butan und Pentano, die am häufigsten. Ebenso sind die radikalen Vinyl und Alilicos Teil dieser Liste.
Andere Alkynd -Radikale, die seltener gefunden werden.
Im folgenden Bild werden einige dieser Radikale mit zugewiesenen Buchstaben dargestellt:
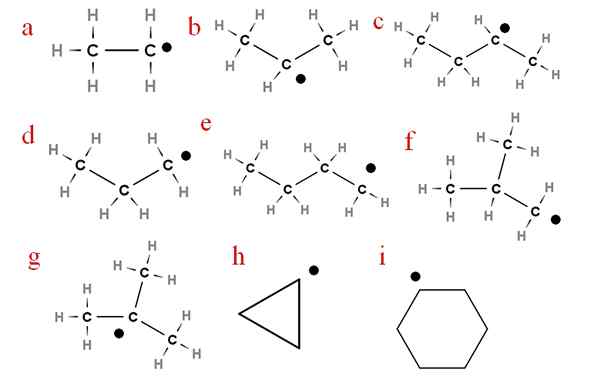 Neun der wichtigsten Alchery -Radikale. Quelle: Gabriel Bolívar.
Neun der wichtigsten Alchery -Radikale. Quelle: Gabriel Bolívar. Beginnend mit dem Brief 'A' haben wir:
-A, Ethylradikal
-B, Isopropylradikal
-C, Secbutylradikal
-D, radikaler Propyl
-E, radikal N-Butyl
-F, isobutil radikal
-G, Ter-Butylradikal
-H, radikaler Cycropilus
-Ich, radikaler Cyclohexil
Jedes dieser Radikale kann ihre Hydringen durch andere Gruppen ersetzt haben oder nicht, sodass sie gleichermaßen wie die Alkane und ihre strukturellen Isomere variieren.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10. Ausgabe.). Wiley Plus.
- Wikipedia. (2020). Alkyl. Abgerufen von: in.Wikipedia.Org
- Chemistry Librettexts. (5. Juni 2019). Struktur von Alkylradikalen: Hyperkonjugation. Erholt von: Chem.Librettexts.Org
- « Überqueren der Referenzen Konzept, Funktionen, Beispiele
- Eigenschaften von Wassertieren, Atmung, Typen, Beispiele »

