Struktur von Radio, Eigenschaften, Verwendungen, erhalten
- 4077
- 1291
- Joy Hort
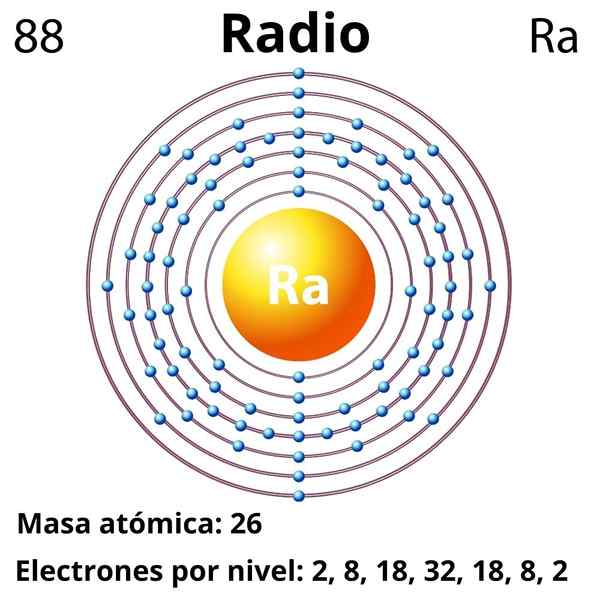
Er Radio Es ist ein metallisches Element, das zu Gruppe 2 des Periodensystems gehört, der alkalinotherrous Metalle, deren chemisches Symbol RA ist. Es ist das letzte Mitglied dieser Gruppe, das sich unter dem Barium befindet, und vor den radioaktiven Elementen wie Thorium und Uran. Der Radius ist jedoch ungefähr eine Million Mal radioaktiv und daher gefährlicher als Uran selbst.
Es ist ein Element, das von unglaublichen und unglücklichen Geschichten umgeben ist, alle aufgrund der Unkenntnis seiner negativen Auswirkungen auf die Gesundheit. Die bläuliche Helligkeit ihrer Salze und wässrigen Lösungen faszinierte die Wissenschaftler Pierre und Marie Curie, die sie im Jahr 1898 entdeckten, die eine unerklärliche und starke Bestrahlung aus Proben des Pechblenda -Erzes analysierten, zu denen ihr Uran- und Uraninhalt ihren Uraniumgehalt und ihren Uraniumgehalt und ihren Uraniumgehalt und ihren Uraniumgehalt entfernt hatte Polonium.
 Illustration von Marie Curie, Entdeckung des Radios
Illustration von Marie Curie, Entdeckung des Radios Elan und Polonium beseitigt, den Curie und kamen zu dem Schluss, dass in der Pechblenda ein anderes Element vorhanden war, das für die starke Strahlung verantwortlich ist, die genial quantifizieren konnte. Dieses neue Element war dem Barium chemisch sehr ähnlich; Im Gegensatz zu seinen spektralen grünen Linien hatten diejenigen jedoch eine karminische Farbe.
So erhielten sie nach der Verarbeitung, Reinigung und Analyse von Tonnen von Pechblenda 0 0.1 mg RACL2. Bis dahin hatten sie 1902 die Atommasse des Radios bereits bestimmt, deren Name aus dem lateinischen Wort "Radius" abgeleitet wurde, was "Strahl" bedeutet,. Das Radio ist buchstäblich ein strahlendes Element.
Acht später, im Jahr 19102 Verwenden von Quecksilber. Das Forschungsfieber wurde geboren, das später zu einem alarmierenden kommerziellen, kulturellen und medizinischen Sensation wurde.
[TOC]
Struktur
Das Radio ist ein Metall, dessen Atome sehr sperrig sind. Eine Folge davon ist, dass ihre Kristalle nur wenige dicht sind (wenn auch etwas mehr als die von Bario), und eine Kubikstruktur annehmen, die sich auf den Körper (BCC) konzentriert (BCC). Aus dieser Struktur wird kein anderer Alotrope anderen Temperaturen oder Drücken gemeldet.
Elektronische Konfiguration

Die elektronische Konfiguration für das Radio lautet wie folgt:
[RN] 7S2
Es oxidiert mit enormer Leichtigkeit, um das Kation RA zu werden2+, das ist isolektronisch bis edelradongas. Daher enthalten alle Radiusverbindungen die Kation RA2+, überwiegend ionische Wechselwirkungen etablieren; Es wird jedoch geschätzt, dass es möglich ist, dass es aufgrund relativistischer Effekte Verbindungen mit einem bemerkenswerten kovalenten Charakter bilden kann (RA-X).
Kann Ihnen dienen: Kaliumbenzoat: Struktur, Eigenschaften, erhalten, verwendet, verwendetRadioeigenschaften
 Funkverbindungsprobe
Funkverbindungsprobe Aussehen
Das Radio ist ein silbernes weißes Metall, das sofort gelb färbt und dunkel, wenn sie mit dem Stickstoff aus der Luft reagiert, um seinen Nitruro zu bilden, RA3N2. Um so schwer zu manipulieren, gibt es nur wenige physikalische Eigenschaften des Radius, die direkt bestimmt wurden.
Ordnungszahl
88
Molmasse
226.03 g/mol
Schmelzpunkt
Ungefähr 700 ºC. Diese Größe konnte nicht genau bestimmt werden.
Siedepunkt
Das Radio kocht zwischen 1100 und 1700 ºC. Dieser große Ungenauigkeitsraum spiegelt wiederum die Komplikationen bei der Manipulation eines solch instabilen Metalls wider.
Dichte
5.5 g/cm3
Fusionshitze
8.5 kJ/mol
Verdampfungswärme
113 kJ/mol
Oxidationszustand
Das Radio hat einen einzelnen +2 Oxidationszustand.
Elektronegativität
0.9. Dieser Wert entspricht treu dem starken elektropositiven Charakter des Radius.
Ionisationsenergien
Erstens: 509.3 kJ/mol
Zweitens: 979 kJ/mol
Radioaktivität
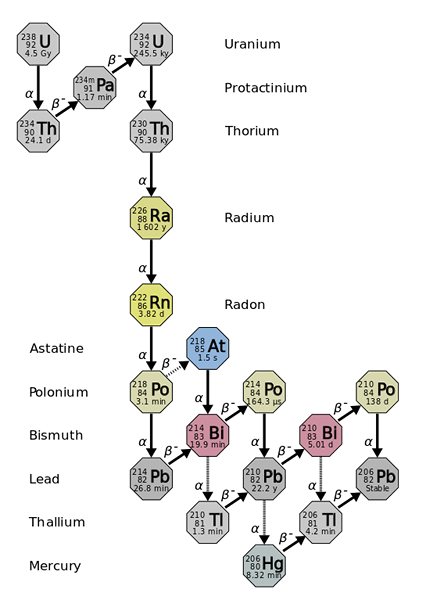 Der Radius leitet. Quelle: Benutzer: Tosaka, CC von 3.0, über Wikimedia Commons
Der Radius leitet. Quelle: Benutzer: Tosaka, CC von 3.0, über Wikimedia Commons Der Radius ist ungefähr eine Million Mal radioaktiv als Uran. Dies liegt hauptsächlich daran, dass andere Isotope daraus hergestellt werden, wie z 222RN (überlegenes Bild), das wiederum abfällt, indem sie α -Partikel emittieren, um sich in das Isotop zu verwandeln 218Po. Eine Funkprobe stellt daher große Mengen an α- und β -Partikeln aus-, sowie γ -Strahlen.
Zum Beispiel leidet ein Gramm Radio 3.7 · 1010 Auflösungen pro Sekunde messen Sie, die dazu dienten, die CI -Einheit Curie zu definieren. Diese Energie reicht aus, um eine Probe von 25 Gramm Wasser 1 ° C pro Stunde zu erhitzen.
Wenn die Zerfallskette beobachtet wird, ist ersichtlich, dass das anfängliche Isotop die 238U, du hast eine T1/2 von 4.5 Giga -Jahre (Milliarden Jahre); während stattdessen die 226Ra hat a T1/2 1600 Jahre, was auch Isotope mit produziert T1/2 von nur wenigen Tagen, Minuten und Sekunden.
Die Radioaktivität des Radios und seiner Verbindungen ist ionisieren, so dass fluoreszierende Substanzen, sogar die umgebenden Atome, während der Nacht aufleuchten und explosive Reaktionen auslösen können. Diese Eigenschaft ist als Radiolumineszenz bekannt.
Verbindungen und Reaktivität
Wenn Salze oder Funkverbindungen in einem Feuerzeug erhitzt werden, feuern sie eine Karminflamme ab. Solche Feststoffe sind normalerweise weiß oder farblos, aber sie sind gelb gefärbt und verdunkeln sich schließlich aufgrund der Radioaktivität von Radioatomen. Wenn sie Bariumverunreinigungen haben, können sie rosa Töne zeigen.
Kann Ihnen dienen: Doppel -Substitution -ReaktionDie Radiochemie ist der von Bario sehr ähnlich, als wären sie zwei untrennbare Brüder, Ra-ba. Beide bilden die gleichen Salze, unlöslich im Wasser, mit dem Unterschied, dass die des Radius etwas unlöslicher sind. Zum Beispiel Radioulfat, Satin4, Es ist unlöslicher als Bariumsulfat, Baso4; Tatsächlich ist es das unlöslichste Sulfat, das jemals bekannt ist: 2.1 mg davon löst sich nur in 1 Liter Wasser auf.
Andererseits Radio Hydroxid, RA (OH)2, Es ist das löslichste und grundlegendste aller Hydroxide ihrer Kollegen.
In Lösung, RA -Kationen2+, Anstatt sich wie Lewis -Säuren zu verhalten, sind sie grundlegend, da ihre große Größe es den Molekülen unmöglich macht.
Die chemische Analogie zwischen dem Radio und dem Barium kehrt zu diesem Metall zurück zu trennen, da seine Salze mit denen des Bariums kopiert werden.
Radio verwendet/Anwendungen
Leuchtende Uhren
 Die leuchtenden und phosphoreszierenden Uhren waren im neunzehnten Jahrhundert für ihre visuelle Attraktivität und die Eindämmung des gefeierten Radios in ihren Gemälden sehr erwünscht. Quelle: Weapon95, CC BY-SA 3.0, über Wikimedia Commons
Die leuchtenden und phosphoreszierenden Uhren waren im neunzehnten Jahrhundert für ihre visuelle Attraktivität und die Eindämmung des gefeierten Radios in ihren Gemälden sehr erwünscht. Quelle: Weapon95, CC BY-SA 3.0, über Wikimedia Commons Die beliebteste und umstrittenste Verwendung des Radius war als Additiv für die Gemälde der Uhren verwendet. Seine Atome wurden in die Pasty -Formulierungen von Zinksulfid Zns eingebaut, die radioaktive Emissionen absorbierten, um ein grünes und phosphoreszierendes Licht freizusetzen. Die Farbe wurde auf die Uhr Hände aufgetragen (überlegenes Bild).
Das Problem dieser Verwendung war die kontinuierliche radioaktive Belichtung, die die Benutzer dieser Uhren beeinflusste. Oder schlimmer noch, für die Arbeiter, die sie in den Fabriken gemalt haben.
1924 begannen mehrere Mitarbeiter, die in einer Lackbranche arbeiteten, die später als Radio -Mädchen (Radium Girls) bekannt sind in der Lage, radioaktive Farbe auf Uhren aufzutragen.
Dies und die Unkenntnis des Radius und die geringe Ethik, keine Schutzmaßnahmen vorzuschlagen, die die Sicherheit der Arbeitnehmer garantierten.
Kann Ihnen dienen: Miet -Halogenuros: Eigenschaften, erhalten, BeispieleFunkmalereien wurden 1960 nicht mehr hergestellt. Obwohl heute mehrere Sammelproben gibt, die es auf ihren Oberflächen haben.
Radithor
 Radithor -Flasche im National Museum of Nuclear Science and History in New Mexico ausgestellt. Quelle: Sam Larussa aus den Vereinigten Staaten von Amerika, CC BY-SA 2.0, über Wikimedia Commons
Radithor -Flasche im National Museum of Nuclear Science and History in New Mexico ausgestellt. Quelle: Sam Larussa aus den Vereinigten Staaten von Amerika, CC BY-SA 2.0, über Wikimedia Commons Der Radithor war eines von vielen pharmazeutischen und kosmetischen Produkten, die die Funkeffizienz für die Bekämpfung von tausend und eins krank waren. Es enthielt eine mikrometrische Funkmenge, die alle Verdauungs- und endokrinen Krankheiten heilen sollte. 1932, nach dem Tod von Eden Byers, einem seiner inbrünstigsten Verbraucher, verließ der Radithor den Markt.
Strahlentherapie
Nicht alle Radioanwendungen waren sensationell, pseudowissenschaftlich und skrupellose (oder Kriminelle). Es gab auch sehr vorteilhaft für die Gesundheit, zumindest bis einige Zeit. Funksalz, RACL2 und Rab2, Sie werden bei der Krebsbehandlung angewendet, insbesondere bei Knochenkrebs.
Das Isotop 223RA zerstört, wenn sie durch Kalziumionen im Stoffwechsel verwirrt sind, und zerstört am Ende Krebszellen im Knochen.
Viele der therapeutischen Verwendungen des Radius wurden jedoch durch sicherere, wirtschaftliche und effiziente Isotope ersetzt, wie die 60Co und 137CS.
Erhalten
Das Radio ist eines der Elemente, deren Produktion knapp ist: nur etwa 100 Gramm pro Jahr weltweit. Tonnen von Uranorange, wie die Pechblenda (oder Uraninit) Erz, werden nach der Curie -Methode verarbeitet, die bei der Behandlung von Proben mit Natriumhydroxid, Salzsäure und Natriumcarbonat besteht4-Baso4.
Die Satinmischung4-Baso4 Es wurde in ihre jeweiligen Chloride verwandelt, RACL2-Bacl2, Trennung der Kationen RA2+ durch fraktionierte Kristallisationen und schließlich reinigende ionische Chromatographie -Techniken. Der racl2 Es wird durch Elektrolyse reduziert oder reduziert es mit Metallaluminium auf 1200 ° C.
Isotope
Alle Radio -Isotope sind radioaktiv. Vier von ihnen existieren in der Natur als Produkte des radioaktiven Zerfalls von Atomen von 232Th, 235U und 238ODER.
Diese vier Isotope sind: 223RA (T1/2= 11.4 Tage), 224RA (T1/2= 3.64 Tage), 226RA (T1/2= 1600 Jahre) und 228RA (5.75 Jahre). Offensichtlich bestehen fast alle Radioatome aus Isotopenmischungen 226Ra und 228Ra, weil andere schnell zerfallen.
Er 226RA ist der stabilste aller Isotope des Radios, alle anderen sind zu instabil, mit T1/2 Weniger als zwei Stunden.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Radium. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Radium. Erholt von: Britannica.com
- Radioaktivität. (S.F.). Radium: Der radioaktive Kern, der Geschichte machte. Erholt von: Radioaktivität.EU.com
- Cantrill, v. (2018). Die Realitäten von Radium. Nature Chem 10, 898. doi.org/10.1038/S41557-018-0114-8
- Elsevier b.V. (2020). Radium. Scientedirect. Abgerufen von: Scientedirect.com
- « Wind -Erosionsfaktoren, Typen, Folgen, Beispiele
- ITALISCHE PENINERUSULE Geographie, Länder, Flora, Fauna, Klima »

