Synthese -Reaktionstypen, Faktoren, Beispiele
- 4075
- 836
- Said Ganzmann
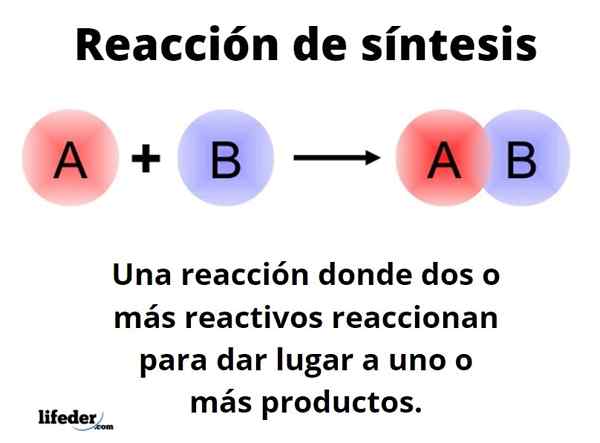
Der Synthesereaktion Es ist eine. Dies ist eine der grundlegendsten Reaktionen der Chemie, und seine Typen und Entwürfe grenzen an fast unendlich.
Generischer Weg kann mit der Form dargestellt werden: a+b → c. In einer einfachen Synthesereaktion, ein Reagenz, das mit einem anderen B -Reagenz reagiert, zur Herstellung eines C -Produkts. Es wird gesagt, dass es aus einem einzigen Schritt besteht. Es kann jedoch passieren, dass zuerst mit E, gefolgt von F und schließlich mit G (andere Reagenzien), um sich in Produkt C zu verwandeln; Das heißt, die gleiche Reaktion findet in mehreren Schritten statt.

Unabhängig von einem einzigen oder vielen Schritt basieren alle Synthesereaktionen auf der Wirksamkeit (Thermodynamik und Kinetik), mit der Reagenzien auf Produkte reagieren, sowie die experimentelle Leistung. Es wird erwünscht, dass eine Synthesereaktion erfolgreich passiert und so viele Produkte wie möglich produziert.
[TOC]
Arten von Synthesereaktionen
Einfach oder mehrfach
Synthesereaktionen sind nicht ganz einfach zu klassifizieren. Es kann ein Problem sein, das sich auf die Kriterien des Chemikers bezieht. Weil? Angenommen, die oben kommentierte Mehrfachreaktion:
A + e → p1
P1 + F → p2
P2 + G → c
P1 Und P2 Vermittler, die nicht von Interesse sind. Die Reaktion der Produktsynthese oder Verbindung C, beginnend von A als Hauptreagenz (begrenzende oder begrenzende Reagenz), ist mehrfach oder komplex, da es in mehreren Schritten auftritt, an denen andere Reagenzien teilnehmen: E, F und G.
Jede der vorherigen drei Reaktionen kann und eine Art chemischer Reaktion in sich selbst bestehen. Das heißt, eine Synthesereaktion kann von jeder anderen Art von chemischen Reaktionen (doppelte Verschiebung, Redox, Verbrennung, Neutralisation, Nitrierung, Substitution usw. sein.) Solange ein Produkt entsteht und eine experimentelle Leistung zugeordnet ist.
So:
A + e → p1
Es kann als einfache Synthesereaktion für Produkt p gesehen werden1, unabhängig von der Art der Reaktion, die ist. Und auch:
P1 + F → p2
Es ist eine weitere einfache Synthesereaktion für das Produkt p2.
Anorganisch oder organisch
Synthesereaktionen können in Bezug auf die Art der Reaktion und ihres molekularen Mechanismus von jeder Art sein. Diese können jedoch nach der chemischen Natur von Reagenzien und Produkten unterteilt werden.
Kann Ihnen dienen: Natriumacetat: Struktur, Eigenschaften, Synthese, verwendetWenn Reagenzien beispielsweise anorganische Substanzen sind, sprechen wir über die anorganische Synthese. Wenn sie organische Substanzen wären, würden wir bereits über organische Synthese sprechen.
Das Feld der organischen Synthese ist kolossal, da sie die Produktionen von Arzneimitteln, Farbstoffen, Kunststoffen, Insektiziden, Klebstoffen, Parfums, Konservierungsstoffen unter Tausenden anderer Produkte abdeckt.
Faktoren, die an Synthesereaktionen beteiligt sind
Die Faktoren, die an Synthesereaktionen beteiligt sind. Einige von ihnen sind die folgenden:
Temperatur
Die Temperatur ist bei jeder Synthesereaktion wesentlich. Abhängig von Ihrer Thermodynamik kann es bequem sein, niedrig oder hoch zu bleiben. Ebenso gibt es Temperaturbereiche, in denen unerwünschte laterale Reaktionen wahrscheinlich sind, daher ist es wichtig, sie zu kontrollieren und jederzeit zu überprüfen.
Zeit
Die Zeit ist auch für Synthesereaktionen von wesentlicher Bedeutung, da sie sicherstellen muss, dass sie ausreicht, um die Einrichtung des Gleichgewichts zu gewährleisten. Nach einer gewissen Zeit wird mehr Produkte aufhören zu erhalten, und dann wird beschlossen, die Synthese vollständig zu stoppen.
Konzentrationen und Qualität der Reagenzien
Je konzentrierter die Reagenzien sind, desto schneller werden die Reaktionen sein. Es ist jedoch auch wichtig, den Anteil seiner Konzentrationen sowie seine Größen klar zu machen, da sich die minimale Änderung auf die endgültige Leistung auswirkt.
Andererseits müssen die Reagenzien so rein wie möglich sein, ansonsten werden fehlerhafte Konzentrationen angenommen. Oder schlimmer noch, die Produkte werden kontaminiert sein, oder unerwünschte Reaktionen treten auf.
Agitation
Die Art und Weise, wie das Reaktionsmedium gerührt wird.
Druck
Der Druck spielt wie Konzentration eine entscheidende Rolle, insbesondere wenn Reagenzien Soda -Arten oder Substanzen sind. Je größer der Druck ist, desto größer ist die Kollisionen oder Wechselwirkungen zwischen den Reagenzien und daher wird es wahrscheinlicher sein, dass sie reagieren.
pH
Der pH -Wert (Säure oder Basic) wirkt sich direkt auf den Mechanismus einer Reaktion aus. Daher ist er ein Schlüsselfaktor bei der Definition, welche Produkte am Ende der Synthese erhalten werden.
Kann Ihnen dienen: Siedepunkt: Konzept, Berechnung und BeispieleKatalysatoren
Katalysatoren sind Substanzen, die chemische Reaktionen beschleunigen, aber während des Prozesses ohne konsumiert werden. Es gibt eine Synthese, dass es ohne Ihre Intervention unmöglich wäre.
Beispiele für Synthesereaktionen
Weiter und schließlich werden chemische Gleichungen für Synthesereaktionen mehrerer Verbindungen zitiert.
Tischsalz (Natriumchlorid)
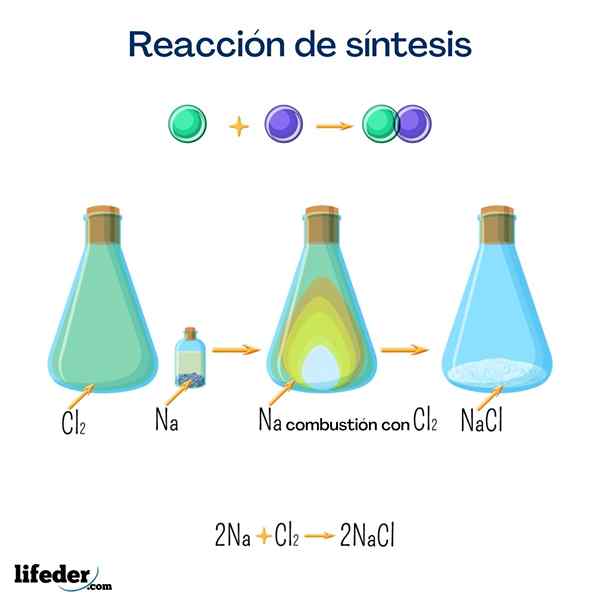
Dieses Salz ist eines der bekanntesten für seinen großen häuslichen Gebrauch. Es wird aus Natrium und Chlor erhalten, und obwohl es durch die folgende Reaktion erhalten werden kann, ist es sehr leicht, es auf natürliche Weise zu finden.
2 na+cl 2 → 2 NaClGlucose
Dies ist eine der wichtigsten Reaktionen für das Leben, um zu existieren, wie wir es kennen. Pflanzen verwenden Kohlendioxid und Umgebung der Umwelt mit Sonnenlicht, um Glukose und Sauerstoff zu erzeugen.
Die Reaktion in sehr allgemeiner Weise ist unten zu sehen, aber es ist wichtig zu verstehen, dass es einige Reaktionen und Mechanismen gibt, damit dies möglich ist.
6CO2 + 6H2O → C6H12O6 + O2
Saccharose
Diese Synthesereaktion tritt in lebenden Organismen auf und wird beim polymerisierenden Glukose mit Fructose angegeben. Aufgrund ihrer Struktur interagieren diese beiden Moleküle und das Endergebnis ist Saccharose und Wasser, wie in der folgenden Gleichung zu sehen ist:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Ammoniak
3 h2(g) + n2(g) → 2 NH3(G)
Die Reagenzien h2 und n2 Sie sind gasförmig. Der Druck muss hoch sein, damit Ihre Moleküle das Ammoniak, NH3. Dies ist eine der wichtigsten Synthesereaktionen der industriellen Chemie.
Wasser
2 h2(g) + oder2(g) → 2 h2O (g)
Die h2 ICH2 reagieren exotherm, um Wasserdampf zu produzieren. Die Menge an freigesetzter Energie ist so, dass Wasserstoff eine der vielversprechendsten Brennstoffe in Luft- und Raumfahrtanwendungen ist.
Alkohol
C2H4(g) + h2Oder (l) → Cho3CH2Oh (l)
Ethanol ist als Alkohol bekannt und ist nur einer der vielen Alkohole, die existieren. Seine Synthesereaktion besteht in der Hydratation von Ethylen, C2H4 oder h2C = Ch2, wo ein Wassermolekül zu seiner Doppelbindung zugesetzt wird.
Schwefelsäure
Schwefelsäure hat mehrere effiziente synthetische Routen. Das einfachste besteht jedoch aus mehreren Schritten:
Kann Ihnen dienen: CarboxymethylcelluloseS (s) +o2(g) → so2(G)
2 Also2(g)+oder2(g) ⇌ 2 so3(G)
SW3(g)+h2Oder (l) → h2SW4(G)
H2SW4(g) → h2SW4(L)
Schwefel brennt mit überschüssigem Sauerstoff, um sich zuerst in so zu verwandeln2, Und dann in so3. Dann das so3 ist hydratisiert, um H -Vaporen zu produzieren2SW4, was endgültig in H kondensiert2SW4 flüssig. Diese Synthese ist so wichtig, dass sie von selbst angibt, wie stark.
Methanol
Co (g) + 2 h2(g) → ch3Oh (l)
Die Gase CO und H2 reagieren und kondensieren auf Metallkatalysatoren, um Methanol zu ergeben, dem einfachsten Alkohol von allen.
Magnesiumsulfat
Es kann aus einer sehr einfachen Reaktion auftreten, die aus Magnesium und Schwefelsäure besteht. Es ist sehr schwierig, es in der Natur ohne Wasser zu finden.
Mg + H2SO4 → H2 + mgso4
Kohlendioxid
Dies geschieht natürlich in mehreren Prozessen, wenn Kohlendioxid mit Kohlendioxidmolekül erzeugt wird.
Es ist in natürlichen Prozessen wie dem Atmen vorhanden, als Reagenz in der Photosynthese und tritt bei Verbrennungsreaktionen leicht auf.
C +O2 → CO2
Salzsäure
Salzsäure wird häufig als billige Säure und als reaktives Mittel zur Synthese anderer Verbindungen verwendet.
CL2+H2 → 2HCL
Kalziumkarbonat
Es ist allgemein als sehr häufig vorkommender Mittel in der Natur bekannt, hauptsächlich in Felsen, Mineralien und Muscheln im Meer. Seine Reaktion basiert auf der Wechselwirkung von Calciumoxid mit Kohlendioxid.
CAO +CO2 → CACO3
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Metler Toledo. (S.F.). Synthesereaktionen. Erholt von: mt.com
- Helmestine, Anne Marie, ph.D. (27. August 2020). Synthese -Reaktionsbeschreibung plus Prüfungen. Von Thakedco abgerufen.com
- Wikipedia. (2020). Chemische Synthese. Abgerufen von: in.Wikipedia.Org
- Danielle Reid. (2020). Synthesereaktion: Definition, Formel und Beispiel. Lernen. Erholt von: Studium.com
- « Teile der Geschichte und ihre Eigenschaften (mit Beispielen)
- Die 10 wichtigsten argentinischen Helden »

