Exergonische Reaktionseigenschaften und Beispiele

- 2600
- 81
- Tizian Liebich
A Exergonische Reaktion Es ist eine, die spontan auftritt und im Allgemeinen von einer Energiefreisetzung in Form von Wärme, Licht oder Schall begleitet wird. Wenn Wärme freigesetzt wird, wird gesagt, dass wir einer exothermischen und exergonischen Reaktion gegenüberstehen.
Deshalb werden die "exotherm" und "exergonischen" Begriffe verwirrt und werden fälschlicherweise als Synonyme behandelt. Dies liegt daran, dass viele exotherme Reaktionen auch exergonisch sind. Wenn daher eine große Ablösung von Wärme und Licht beobachtet wird, wie z.
 Die Holzverbrennung ist ein Beispiel für eine exotherme und gleichzeitig exergonische Reaktion. Quelle: Pixnio.
Die Holzverbrennung ist ein Beispiel für eine exotherme und gleichzeitig exergonische Reaktion. Quelle: Pixnio. Die freigesetzte Energie kann jedoch unbemerkt bleiben und nicht so überraschend sein. Zum Beispiel kann ein flüssiges Medium leicht erhitzen und dennoch eine Folge einer exergonischen Reaktion sein. Bei einigen exergonischen Reaktionen, die zu langsam verlaufen.
Der zentrale und charakteristische Punkt dieser Art von thermodynamischen Reaktionen ist die Abnahme der freien Energie in Gibbs in Produkten in Bezug auf Reagenzien, was zu Spontanität führt.
[TOC]
Eigenschaften exergonischer Reaktionen
Allgemeines Diagramm
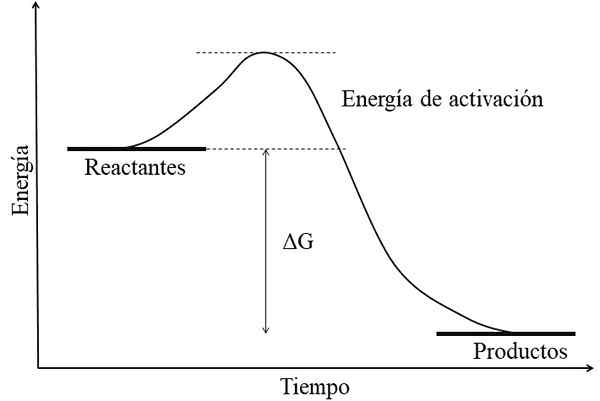 Energiediagramm für eine exergonische Reaktion. Quelle: Gabriel Bolívar.
Energiediagramm für eine exergonische Reaktion. Quelle: Gabriel Bolívar. Das Hauptmerkmal einer exergonischen Reaktion besteht darin, dass die Produkte freie Energien von Gibs, die niedriger sind als die von Reaktanten oder Reagenzien (überlegenes Bild), aufweisen. Diese Tatsache ist normalerweise mit den Produkten verbunden, die chemisch stabiler sind, mit stärkeren Verbindungen, dynamischeren Strukturen oder "bequemeren" Bedingungen.
Daher ist diese Energiedifferenz ΔG negativ (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Kann Ihnen dienen: homogenes SystemAlle diese Variablen, die auf die Art des Phänomens oder die in Betracht gezogene chemische Reaktion reagieren, lassen Sie feststellen, ob eine Reaktion exergonisch ist oder nicht. Und es wird auch ersichtlich, dass es nicht unbedingt eine exotherme Reaktion sein muss.
Wenn die Aktivierungsenergie sehr hoch ist, benötigen die Reaktanten die Hilfe eines Katalysators, um die Energiebarriere zu verringern. Deshalb gibt es exergonische Reaktionen, die bei sehr niedrigen Geschwindigkeiten angegeben sind oder die überhaupt nicht auftreten.
Freie Energieabnahme des Systems
Der folgende mathematische Ausdruck umfasst das, was oben kommentiert wird:
ΔG = ΔH - t & Dgr;
Der Begriff ΔH ist positiv, wenn es sich um eine endotherme Reaktion handelt, und negativ, wenn er exotherm ist. Wenn wir möchten, dass ΔG negativ ist, muss der Begriff TδS sehr groß und positiv sein.
Daher ist dies ein weiteres besonderes Merkmal der exergonischen Reaktionen: Sie implizieren eine große Veränderung der Systementropie.
Unter Berücksichtigung aller Begriffe können wir daher vor einer exergonischen Reaktion anwesend sein, gleichzeitig jedoch endotherme; Das heißt, mit ΔH positiv, einer sehr hohen Temperatur oder einer Änderung der großen Entropie.
Die meisten exergonischen Reaktionen sind ebenfalls exotherm, denn wenn ΔH negativ ist und durch Subtrahieren eines weiteren noch negativeren Terms, werden wir folglich einen ΔG mit negativem Wert haben; Es sei denn, Tδs ist negativ (Entropie steigt ab), und daher würde die exotherme Reaktion endogon werden (nicht spontan).
Es ist wichtig hervorzuheben, dass die Spontanität einer Reaktion (ob exergonisch oder nicht) stark von den thermodynamischen Bedingungen abhängt. Während die Geschwindigkeit, mit der es vorbei ist, auf kinetische Faktoren zurückzuführen ist.
Es kann Ihnen dienen: LEBENS MATERE: Konzept, Merkmale und BeispieleSpontanität einer exergonischen Reaktion
Was gesagt wurde, ist bekannt, da eine exergonische Reaktion spontan ist, ob exotherm. Zum Beispiel kann sich eine Verbindung in der Wasserkühlung zusammen mit ihrem Behälter auflösen. Dieser Auflösungsprozess ist endotherm, aber wenn es spontan passiert, wird gesagt, dass er exergonisch ist.
Exotherme Reaktion
Es gibt "mehr exergonische" Reaktionen als andere. Um herauszufinden, sollte der folgende Ausdruck zur Hand sein:
ΔG = ΔH - t & Dgr;
Die exergonischsten Reaktionen sind diejenigen, die allen Temperaturen spontan gegeben werden. Das heißt, unabhängig vom Wert von t in der vorherigen Expression ist ΔH negativ und ΔS positiv (ΔH 0). Sie sind daher sehr exotherme Reaktionen, was der anfänglichen Idee nicht widerspricht.
Es kann auch exotherme Reaktionen geben, bei denen die Systementropie abnimmt (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Endotherme Reaktion
Andererseits gibt es Reaktionen, die bei hohen Temperaturen nur spontan sind: Wenn ΔH positiv und ΔS positiv ist (ΔH> 0 und ΔS> 0). Wir sprechen über endotherme Reaktionen. Deshalb können Temperaturabfälle spontan auftreten, weil sie eine Erhöhung der Entropie mit sich bringen.
Inzwischen gibt es Reaktionen, die überhaupt nicht exergonisch sind: Wenn ΔH und ΔS positive Werte haben. In diesem Fall wird die Reaktion unabhängig von der Temperatur niemals spontan auftreten. Wir reden dann über eine Ende -Spontane -Endary -Reaktion.
Kann Ihnen dienen: VerbreitungsphaseBeispiele für exergonische Reaktionen
Chemie ist normalerweise durch explosiv und brillant gekennzeichnet. Es wird also angenommen, dass die meisten Reaktionen exotherm und exergonisch sind.
Verbrennungen
Exergonische Reaktionen sind die Verbrennung von Alkanen, Olefinen, aromatischen Kohlenwasserstoffen, Zucker usw.
Metalloxidaxe
Ebenso sind Metalleoxidationen exergonisch, obwohl sie langsamer gehen.
Katabolische Reaktionen des Organismus
Es gibt jedoch auch andere subtilere Prozesse, die auch exergonisch und sehr wichtig sind: die katabolen Reaktionen unseres Stoffwechsels. Hier zersetzen sich die Makromoleküle, die als Energiespeicher fungieren, sich in Hitze und ATP befreien und dank dessen, was der Körper viele seiner Funktionen ausführt.
Die emblematischste dieser Reaktionen ist die Zellatmung gegenüber der Photosynthese, wo Kohlenhydrate mit Sauerstoff "verbrannt" werden, um sie in kleine Moleküle zu verwandeln (Co2 und h2O) und Energie.
Andere
Unter anderen exergonischen Reaktionen haben wir die explosive Zersetzung des Stickstoff -Triayoduro oder3; die Zugabe von Wasser alkalischen Metallen, gefolgt von einer Explosion; polymere Synthese von ethoxylierten Harzen; Säure-Base-Neutralisationen in wässriger Lösung; und Lumineszenzchemotherapie -Reaktionen.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Walter J. Moore. (1963). Physikalische Chemie. In der chemischen Kinetik. Vierte Ausgabe, Longmans.
- Iran. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe, Seite 479-540. Mc Graw Hill.
- Wikipedia. (2020). Exergonische Reaktion. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (16. September 2019). Endgonische gegen exergonische Reaktion und Prozess. Erholt von: thoughtco.com
- Exergonische Reaktion: Definition & Beispiel. (18. September 2015). Erholt von: Studium.com
- Khan Akademie. (2018). Freie Energie. Geborgen von: ist.Khan Akademie.Org
- « Mechanische Energieformeln, Konzept, Typen, Beispiele, Übungen
- Nachhaltiger Verbrauch für die Verwendung, Bedeutung, Maßnahmen, Beispiele »

