Exotherme Reaktion
- 4757
- 743
- René Riediger
Wir erklären, welche exothermen Reaktionen, ihre Merkmale und Unterschiede zu endothermen Reaktionen sind, und geben mehrere Beispiele an
Was sind exotherme Reaktionen?
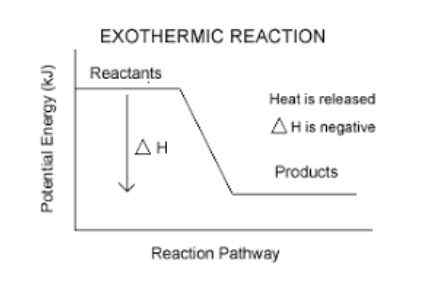
Der exotherme Reaktionen Sie sind chemische Reaktionen, die Energie in Form von Wärme freisetzen. Das exothermische Wort wird von gebildet von "Exo" was bedeutet "out" und "Thermosflasche" was bedeutet Wärme, also bedeutet "exotherme Reaktion" wörtlich, Reaktion, in der Wärme ausgeht.
Diese Reaktionen sind sehr häufig und wir können sie überall finden, von unseren Häusern bis zu den Zellen, die Teil unseres Körpers sind.
Zu Hause finden wir sie in der Küche, wenn das Gas im Horn brennt, um unser Essen zu kochen. Wir finden sie auch in Automotoren, wenn sie Kraftstoff verbrennen.
 Ein Beispiel für exotherme Reaktion
Ein Beispiel für exotherme Reaktion Andererseits sind exotherme Reaktionen für das Leben wesentlich, da sie Zellen die Energie liefern, die sie benötigen, um zu leben, zu wachsen und sich zu reproduzieren.
Eigenschaften exothermer Reaktionen
Sie füllen Energie in Form von Wärme frei
Dies ist das Hauptmerkmal, das sie exotherme Reaktionen macht.
Die freigesetzte Energie stammt aus den gleichen Reagenzien
Jede chemische Reaktion erfordert eine gewisse Aktivierungsenergie, um auftreten zu können. Bei exothermen Reaktionen kommt diese Energie von den gleichen Reagenzien, wenn sie in Produkte umgewandelt werden.
Exotherme Reaktionen Produkte sind immer stabiler als Reagenzien.
Die Reagenzien durch Produkte verlieren einen Teil ihrer Energie in Form von Wärme. Aus diesem Grund bleiben Produkte immer weniger Energie als Reagenzien, was sie stabiler macht.
Sie haben eine negative Enthalpie -Variation.
Dies ist eine einfache Möglichkeit zu wissen, ob eine Reaktion exotherm ist oder nicht. Jede Reaktion, die ein AH (Read Delta H) negativ hat, ist exotherm.
- Zum Beispiel, Die Verbrennungsreaktion des Butans (das Gas, das wir in der Küche verbrennen) hat eine Enthalpievariation von -11.823 kcal/mol. Daher ist es eine exotherme Reaktion.
Sie brauchen nur einen Auslöser in den meisten Fällen auftreten.
Viele exotherme Reaktionen brauchen nur etwas, das ihnen genug Energie gibt, um zu beginnen. Danach reicht die gleiche Hitze, die sie freisetzen.
- Zum Beispiel, Durch Verbrennen von Gas wird nur ein Funke benötigt, dann wird die Flamme weiter eingeschaltet, bis das Gas vorbei ist.
Unterschiede zwischen exothermen Reaktionen und endothermen Reaktionen
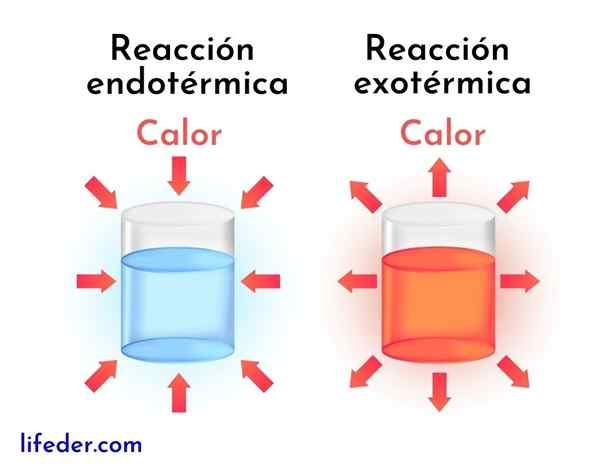
Exotherme Reaktionen sind das Gegenteil von endothermen Reaktionen. In letzterem absorbieren Reagenzien Energie in Form von Wärme, anstatt sie freizusetzen, wie bei exothermen Reaktionen.
Als nächstes werden die Hauptunterschiede zwischen exothermen und endothermen Reaktionen vorgestellt:
Exotherme Reaktionen | Endotherme Reaktionen |
Sie füllen Energie in Form von Wärme frei. | Sie absorbieren Energie in Form von Wärme. |
Sie haben eine negative Enthalpie -Variation, dh dh<0. | Sie haben eine positive Enthalpievariation, das ist dh> 0. |
Sie neigen dazu, die umliegende Temperatur zu erhöhen. | Sie neigen dazu, die Temperatur zu reduzieren oder sich abzukühlen. |
Die Energie, die die Reaktion beim Gehen hält, kommt von den gleichen Reagenzien. | Die Energie, die die Reaktion beim Gehen hält, kommt von der Umgebung. |
Stabilere Produkte werden immer mit weniger Energie gewonnen. | Weniger stabile Produkte werden immer mit einem höheren Energieniveau erhalten. |
Beispiele für exotherme Reaktionen
Die Verbrennung von Küchengas
In den meisten Häusern der Welt ist das Gas zum Kochen von Lebensmitteln Butan, das die molekulare Formel C hat4H10. Dieser Kohlenwasserstoff wird durch die nächste Verbrennungsreaktion mit dem Sauerstoff der Luft verbrannt, wobei große Mengen an Wärme freigesetzt werden:
Kann Ihnen dienen: Einfaches Mikroskop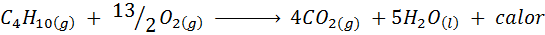
Die Explosion von Dynamit
Dynamit enthält einen explosiven namens Nitroglycerin (C. C3H5N3ENTWEDER9). Diese Verbindung zert. Die chemische Reaktion ist:
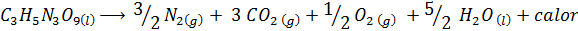
Diese Reaktion hat a ΔH = -368 kcal⁄mol, Es ist also eine exotherme Reaktion.
Spontane Verbrennung von weißem Phosphor
Das Phosphorelement (P) kann als roter Phosphor oder weißes Phosphor gefunden werden. Weißer Phosphor. Die Reaktion ist:
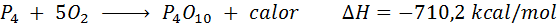
Zellenatmung
Die zelluläre Atmung ist eine exotherme chemische Reaktion, die in der Oxidation der Nahrung, die wir essen, bestehen. Die durch diese Reaktion freigesetzte Wärme wird von Zellen verwendet, um endlose endotherme chemische Reaktionen durchzuführen, die Energie erfordern.
Feuerwerk
Feuerwerkskörper enthalten schwarze Schießpulver als Hauptsprengkomponente. Schießpulver ist eine Mischung, die Kaliumnitrat, Graphit und Schwefelkohlenstoff enthält, die durch eine exotherme Reaktion miteinander reagieren. Die Wärme, die diese Reaktion freigibt, erzeugt die breite Palette von Farben, die wir im Himmel sehen, wenn Feuerwerkskörper explodieren.
Das chemische Wärmekissen
Wärmekissen werden als heiße Kompressen verwendet, um Sportverletzungen zu lindern. Diese bestehen aus einem versiegelten Beutel mit Wasser und einem Chemiker in einem kleinen Rohr. Wenn das Rohr zerbrochen ist, wird der Chemiker mit dem Wasser gemischt, der eine exotherme chemische Reaktion erzeugt, die das Pad erhitzt.
Metallische Natriumreaktion mit Wasser
Natrium. Die Reaktion ist:
Es kann Ihnen dienen: Methoden zur Trennung heterogener Gemische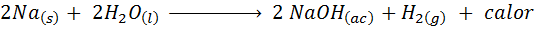
Diese Reaktion veröffentlicht 1900 Kalorien für jede Gramm Na, die mit Wasser reagiert. Dies bedeutet, dass 1 Gramm Natrium ausreichen würde, um 3 mittelgroße Kaffeetassen zu erhitzen.
Waschmittelauflösung
Dies ist eine Reaktion, die jeder in seinem Haus erleben kann. Wenn Sie eine Handvoll Waschmittel einnehmen, um Kleidung zu waschen und sie mit etwas Wasser zu befeuchten, fühlt sich die Hand sofort heiß an. Dies liegt daran, dass der Prozess der Auflösung des Waschmittels im Wasser exotherm ist.
Die Trimita -Reaktion
Die Termita ist eine Mischung aus Aluminium in Form eines sehr feinen Pulvers und eines Oxids eines anderen Metalls wie Eisen. Nach einem Funken ist die Reaktion, die auftritt,:
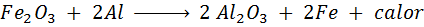
Diese Reaktion setzt so viel Wärme frei, die in der Lage ist, Eisen zu schmelzen und viel zum Schweißen von Bahnschienen verwendet wird.
Wasserkondensation
Für alle Substanzen, Gasphasenänderungen (Kondensation), flüssige bis feste (Verfestigung) und festes Gas (Abscheidung) füllen Sie immer Wärme frei und sind daher exotherme Prozesse. Im Falle von Wasser setzt die Kondensation von nur 18 Gramm Wasser ungefähr 10 frei.000 Kalorien, was ausreicht, um 15 kleine Kaffeetassen zu heizen.
Verweise
- Chang, R. und Goldsby, k. (2014). Chemie. 11. Aufl. New York: McGraw-Hill-Ausbildung.
- Exotherme Reaktion (2020, 19. Dezember). In Wikipedia. Genommen von.Wikipedia.Org
- Holmes, w. S. (1963). Verbrennungswärme von Phosphor und Enthalpien der Bildung von P4O10 und H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. von einem., F. Yo. (2014). Kracher, Raketen und viel Chemie. Chemische Ausbildung. 44-51. Doi: 10.2436/20.2003.02.134
- Thermitenreaktion. Universität von Minnesota (Abteilung für Chemie). Entnommen von Chem.Umn.Edu

