- 3240
- 677
- René Riediger
A Reversible Reaktion . Es wird auch gesagt, dass ein solcher Zustand einem dynamischen Gleichgewicht entspricht.
Das Gleichgewicht konnte jedoch als Folge der Reversibilität einer chemischen Reaktion gesehen werden; Da es bei irreversiblen Reaktionen unmöglich ist, ein Gleichgewicht herzustellen. Damit dies geschieht, müssen die Produkte unter bestimmten Druck- und Temperaturbedingungen aufeinander reagieren können.
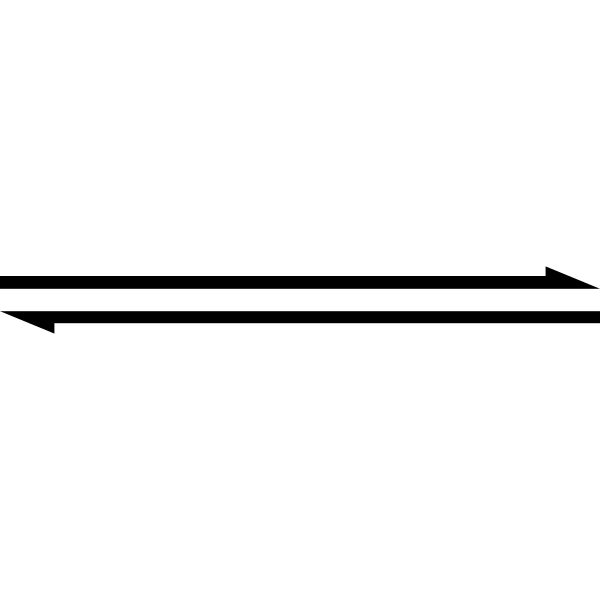
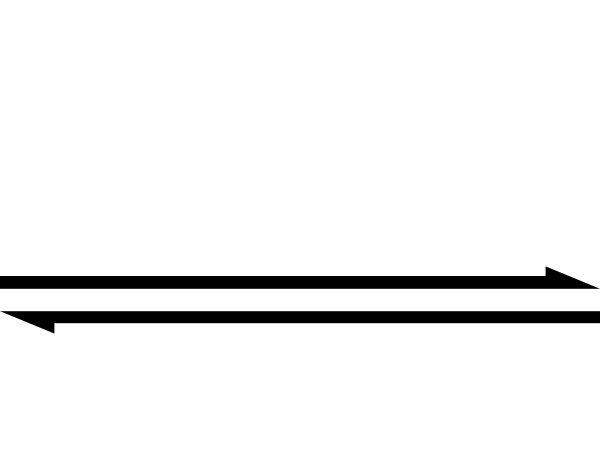 Das Doppelpfeilsymbol zeigt an, dass eine Reaktion reversibel ist. .Cette Bild SVG A ETé Créée Par Perium69.
Das Doppelpfeilsymbol zeigt an, dass eine Reaktion reversibel ist. .Cette Bild SVG A ETé Créée Par Perium69. Das obige ist vereinfacht, indem das Doppelpfeilsymbol verwendet wird (mit zwei antiparallelen Spitzen). Wenn wir es in einer chemischen Gleichung sehen, bedeutet dies, dass die Reaktion in beide Richtungen verläuft: von links nach rechts (Produktbildung) und von rechts nach links (Reagenz oder reaktive Bildung).
Die Minderheit der chemischen Reaktionen ist reversibel und sie werden mehr als alle in organischer und anorganischer Synthese gefunden. In diesen ist es von großer Bedeutung zu wissen, welche Bedingungen das Gleichgewicht bevorzugen, um die Produktionsmengen zu schätzen, die erhalten werden können.
[TOC]
Eine reversible Reaktion hat die folgende allgemeine Gleichung, wenn man bedenkt, dass es nur zwei Reagenzien gibt, A und B:
A + b ⇌ c + d
Der Doppelpfeil zeigt an, dass A und B auf C und D reagieren, aber auch C und D aufeinander reagieren können, um die Reagenzien zu regenerieren. Das heißt, die Reaktion in die entgegengesetzte Richtung von rechts nach links findet statt.
Kann Ihnen dienen: Was ist der Eristeno?Die direkte Reaktion entsteht Produkte, während die umgekehrten Reagenzien. Wenn einer exotherm ist, muss die andere nach Logik endotherm sein und beide spontan auftreten; Aber nicht unbedingt mit der gleichen Geschwindigkeit.
Zum Beispiel kann A und B kleiner oder instabil sein als C und D; Und deshalb konsumieren sie schneller als C und D sie regenerieren können.
Wenn die Produkte C und D kaum aufeinander reagieren, wird es eine stärkere Ansammlung von Produkten als Reagenzien geben. Dies bedeutet, dass wir, wenn das chemische Gleichgewicht erreicht ist.
Es wird dann gesagt, dass das Gleichgewicht nach links verschoben wird, wo es mehr Produkte als Reagenzien geben wird.
Le châtelier Prinzip
Eine reversible Reaktion ist gekennzeichnet, indem in einer chemischen Gleichung in beide Richtungen stattfindet, einen Gleichgewichtspunkt erreicht und auf externe Veränderungen oder Einflüsse nach Le Châteliers Prinzip reagiert.
Dank dieses Prinzips konnten die Beobachtungen des Boxhollets 1803 erklärt werden, als er Na -Kristalle erkannte2CO3 In einem Sandsee in Ägypten. Die Doppelverschiebungsreaktion wäre:
N / A2CO3(AC) + CaCl2(Ac) ⇌ NaCl (AC) + Caco3(Ac)
Damit die umgekehrte Reaktion stattfinden kann, muss es einen Überschuss an NaCl geben, und somit würde sich das Gleichgewicht nach rechts bewegen: Auf dem Weg zur Bildung von Na2CO3.
Dieses Merkmal ist von großer Bedeutung, da die Drucke oder Temperaturen auch manipuliert werden, um die Bedeutung der Reaktion zu bevorzugen, die durch die interessierenden Arten erzeugt wird.
Chemische Veränderungen
Die chemischen Veränderungen reversibler Reaktionen sind in der Regel weniger offensichtlich als die für irreversiblen Reaktionen beobachteten. Es gibt jedoch Reaktionen, insbesondere diejenigen, an denen Metallkomplexe teilnehmen, an denen wir temperaturabhängige Färbungsänderungen sehen.
Kann Ihnen dienen: Perrin Atommodell: Merkmale, PostulateChemische Spezies
Jede Art von Verbindung kann an einer reversiblen Reaktion beteiligt sein. Es wurde ersichtlich, dass zwei Salze in der Lage sind, ein Gleichgewicht herzustellen, NA2CO3 und Cacl2. Das gleiche geschieht zwischen Metallkomplexen oder Molekülen. Tatsächlich ist ein Großteil der reversiblen Reaktionen auf Moleküle mit spezifischen Verbindungen zurückzuführen.
Beispiele für reversible Reaktionen
Auflösung von Kobaltchlorid
Eine Kobaltchloridlösung, COCl2, In Wasser färbt es rosa, aufgrund der Bildung einer komplexen ACU. Wenn diese Lösung erhitzt wird, ändert sich die Farbe in Blau und ergibt die nächste reversible Reaktion:
[CO (h2ENTWEDER)6]2+(ac) (rosa) + 4cl-(Ac) + q ⇌ cocl42-(ac) (blau) + 6h2Oder (l)
Wo ist die Wärme geliefert?. Diese Wärme dehydriert den Komplex, aber wenn die Lösung abkühlt oder wenn Wasser hinzugefügt wird, kehrt sie zu seiner ursprünglichen rosa Farbe zurück.
Wasserstoff Iodid
Die folgende reversible Reaktion ist vielleicht die klassischste bei der Einführung des Konzepts des chemischen Gleichgewichts:
H2(g) + i2(s) ⇌ 2hi (g)
Beachten Sie, dass die Reaktion es schafft, ein Gleichgewicht zu schaffen, auch wenn sich das Jod im Festkörper befindet. Alle Arten sind molekular: H-H, I-I und H-I.
Hydrolyse
Hydrolyse sind sehr repräsentative Beispiele für reversible Reaktionen. Unter den einfachsten haben wir denjenigen, der unter einer konjugierten Säure oder einer Base gelitten hat. Die Hydrolyse des Ammoniumions NH4+, und vom Carbonation, co32-, sind die folgenden:
NH4+(Ac) + h2Oder (l) ⇌ nh3(g) + oh-
CO32-(Ac) + h2Oder (l) ⇌ hco3-(Ac) + oh-
Wenn wir eine Basis hinzufügen, die Ionen OH liefert- In der Mitte werden wir beide Guthaben links verdrängen.
Kann Ihnen dienen: Gadolinio: Struktur, Eigenschaften, erhalten, verwendet, verwendetChromat-Domato-Auflösung
Sehr ähnlich wie im ersten Beispiel, eine Chromatlösung erfährt eine Farbänderung, jedoch aufgrund von Temperaturschwankungen, aber pH. Die reversible Reaktion ist:
2Cro42-(ac) (gelb) + 2h3ENTWEDER+(Ac) ⇌ Cr2ENTWEDER72-(Ac) (orange) + 3h2Oder (l)
Also, wenn eine gelbe CRO -Auflösung42- Es ist mit jeder Säure angesäuert, seine Farbe wird sofort orange. Und wenn es alkalisch oder viel Wasser zugesetzt wird, bewegt sich das Gleichgewicht nach rechts, taucht die gelbe Farbe wieder auf und verbraucht die Cr2ENTWEDER72-.
Ammoniak
Die Synthese von Ammoniak, NH3, Es beinhaltet eine reversible reversible Reaktion, so dass gasförmiger Stickstoff, eine sehr inerte Spezies, reagiert:
N2(g) + 3h2(s) ⇌ 2nh3(G)
Veresterung
Und schließlich wird ein Beispiel für organische Chemie erwähnt: Veresterung. Dies besteht darin, einen Ester aus einer Carbonsäure und einem Alkohol in starkem saurem Medium zu erhalten. Die reversible Reaktion ist:
Rcooh + r'oh ⇌ rcoor ' + h2ENTWEDER
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Walter J. Moore. (1963). Physikalische Chemie. In der chemischen Kinetik. Vierte Ausgabe, Longmans.
- Iran. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe, Seite 479-540. Mc Graw Hill.
- Wikipedia. (2020). Reversible Reaktion. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (19. August 2019). Reversible Reaktionsdefinition und Prüfungen. Erholt von: thoughtco.com
- Binod Shrestha. (5. Juni 2019). Reversible und irreversible Reaktionen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- David Wood. (2020). Reversible chemische Reaktionen: Definition & Prüfungen. Lernen. Erholt von: Studium.com

