Exotherme und endotherme Reaktionen
- 3931
- 570
- Timo Rabenstein
 Die Verbrennung ist ein Beispiel für exotherme Reaktion, da sie Wärme freigibt. Das Eis schmilzt seinerseits durch eine endotherme Reaktion, da es Wärmeenergie benötigt
Die Verbrennung ist ein Beispiel für exotherme Reaktion, da sie Wärme freigibt. Das Eis schmilzt seinerseits durch eine endotherme Reaktion, da es Wärmeenergie benötigt Der exotherme und endotherme Reaktionen Sie unterscheiden.
In ähnlicher Weise können andere Energiearten an chemischen Reaktionen beteiligt sein, da manchmal während der Reaktion, Lichtenergie, Schallenergie und sogar Strom erzeugt werden.
Um nicht nur Wärme, sondern auch andere Arten von Energie zu berücksichtigen, werden chemische Reaktionen als klassifiziert als exergonisch Und Endermanics. Eine exergonische Reaktion fördert Energie, wenn sie produziert werden, während ein Endgonic sie absorbiert.
In diesem Fall ist eine exotherme Reaktion auch eine exergonische Reaktion, da sie Wärme freigibt. Eines der bekanntesten Beispiele ist die Verbrennung. Jedes Mal, wenn ein Stück Holz verbrannt wird, wird Kalorien und helle Energie freigesetzt.
Andererseits tritt eine der am besten bekannten endeilenden chemischen Reaktionen beim Schmelzen eines Eiswürfel auf, da Eis thermische Energie der Umwelt absorbiert, um sich in flüssiges Wasser zu verwandeln.
Eine exotherme Reaktion kann spontan auftreten, obwohl Sie manchmal etwas Arbeit machen müssen, um zu beginnen. Damit jedoch eine endotherme Reaktion auftritt.
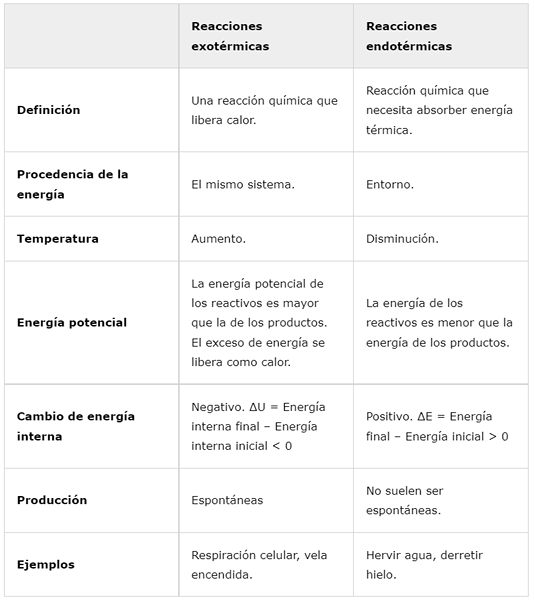
Exotherme Reaktionen | Endotherme Reaktionen | |
Definition | Eine chemische Reaktion, die Wärme freigibt. | Chemische Reaktion, die die thermische Energie absorbieren muss. |
Ursprung der Energie | Das gleiche System. | Um. |
Temperatur | Zunahme. | Verringern. |
Potenzielle Energie | Die potentielle Energie der Reagenzien ist größer als die der Produkte. Überschüssige Energie wird als Wärme freigesetzt. | Die Energie der Reagenzien ist geringer als die Energie der Produkte. |
Interne Energieveränderung | Negativ. ΔU = endgültige interne Energie - anfängliche interne Energie < 0 | Positiv. ΔE = endgültige Energie - Anfangsenergie> 0 |
Produktion | Spontan | Sie sind normalerweise nicht spontan. |
Beispiele | Zelluläres Atmen, brennende Kerze. | Wasser kochen, Eis schmelzen. |
Exotherme Reaktionen
Definition
Art der chemischen Reaktion, die Wärme freigibt, wenn sie durchgeführt wird.
Es kann Ihnen dienen: Cyclohexen: Struktur, Eigenschaften, Synthese und VerwendungUrsprung der Energie
Das gleiche System liefert Energie, damit die Reaktion auftritt.
Temperatur
Nach der Reaktion gibt es a Zunahme Temperatur.
Potenzielle Energie
Wenn eine chemische Reaktion zwischen den Reagenzien auftritt, werden Verbindungen zwischen ihnen und anderen gebrochen, um neue Moleküle zu erzeugen. Aber nicht alle Verbindungen vereinen Atome und Moleküle mit derselben Kraft, daher ist die Energie zum Brechen oder Erstellen jeder Verbindung unterschiedlich.
Während jeder Reaktion brechen sie und erzeugen unterschiedliche Anzahl von Links, so dass Energie unterschiedlich ist. In einer exothermen Reaktion die potentielle Energie der Reagenzien ist älter als die der Produkte, und da die Energie erhalten bleibt, wird der Überschuss als Hitze freigesetzt.
Interne Energieveränderung
Die interne Energie hängt mit der Fähigkeit des Systems zusammen, Arbeit auszuführen, und umfasst seine potenzielle Energie und seine kinetische Energie. Die absolute Energie des Systems wird nicht bestimmt, sondern seine Variation, die als ΔU bezeichnet wird.
Nach dem, was im vorherigen Abschnitt gesagt wurde, ist die Änderung der internen Energie ΔU negativ.
ΔU = endgültige interne Energie - anfängliche interne Energie < 0
Produktion
Die meisten exothermen Reaktionen sind spontan, Das heißt, sie finden für sich selbst statt, ohne dass externe Energie hinzugefügt werden muss, bis die Reagenzien erschöpft sind.
Beispiele
Normalerweise sind Oxidationsreaktionen und solche, die zur Bildung von Verbindungen führen, normalerweise exotherme Reaktionen:
1. Waschmittel in Wasser auflösen
Beim Auflösen von Kleidungsstaub in etwas kaltem Wasser fühlt er sich warm, wenn er ihn berührt.
2. Zellenatmung
Bei Tieren und Pflanzen wird der zelluläre Atemprozess als Teil des Kohlenstoffzyklus durchgeführt. Atmung verwendet Glukose und Sauerstoff, um Kohlendioxid, Wasser und Energie gemäß der Reaktion zurückzugeben:
Kann Ihnen dienen: Titanoxid (IV): Struktur, Eigenschaften, verwendetC6H12ENTWEDER6 + 62 → 6co2 + H2O + Energie (ATP)
3. Eine brennende Kerze
Zusätzlich zu Licht gibt eine brennende Kerze Wärme und andere Substanzen aus:
Sauerstoffsauerstoff → Wasser + Kohlendioxid + Licht und Wärme
4. Der Bombenkäfer
Dieses Insekt verteidigt sich, indem er ein Aerosol über seine Raubtiere besprüht. Der Käfer hält Flüssigkeiten und Enzyme in separaten Kompartimenten, die sich in seinem Bauch befinden.
Wenn es bedroht ist, wird die Flüssigkeiten in Richtung des Enzymkompartiments ausgewiesen, und eine chemische Reaktion, die Dampf und Wärme erzeugt.
5. Stahl- und Essigwolle
Ein Metall wie Eisen wird bei der Reaktion mit der Umwelt langsam oxidiert. Wenn jedoch ein wenig Stahlwolle Essig zugesetzt wird, wird beobachtet, dass die Oxidation viel schneller ist und gleichzeitig Wärme erzeugt.
Endotherme Reaktionen
Definition
Reaktionen, bei denen Reagenzien Wärmeenergie absorbieren müssen, damit die Produkte erhalten werden.
Ursprung der Energie
Die Energie, die für die Ausführung der Reaktion erforderlich ist, geht aus der Umwelt aus.
Temperatur
Die endotherme Reaktion beinhaltet a verringern Temperatur.
Potenzielle Energie
Im Gegensatz zu dem, was mit einer exothermen Reaktion passiert, ist die Energie der Reagenzien Es ist weniger dass die Energie der Produkte.
Interne Energieveränderung
In einer endothermen Reaktion ist die Veränderung der inneren Energie ΔE positiv.
ΔE = endgültige Energie - Anfangergie> 0
Daher ist die endgültige Energie größer als die Anfangs.
Produktion
Endothermische Reaktionen erfordern, dass die Arbeit am System durchgeführt wird, sodass sie normalerweise nicht spontan sind.
Es gibt jedoch einige endotherme Reaktionen wie das Schmelzen von Eis und die Verdunstung bestimmter Flüssigkeiten, die bei Raumtemperatur spontan sind.
Es wird dann zu dem Schluss gezogen, dass die Temperatur der Umgebung ein bestimmender Faktor für die Spontanität einer chemischen Reaktion ist.
Es kann Ihnen dienen: Chemische Indikatoren: Wofür sind sie, Typen, BeispieleBeispiele
Viele der Reaktionen mit Salzauflösung und im Allgemeinen sind die Substanzabzersetzung normalerweise endotherm. Auf die gleiche Weise sind der Durchgang von Eis zu flüssig.
1. Photosynthese
Die Pflanzen führen eine chemische Reaktion in Gegenwart von Sonnenlicht durch, in dem sie Kohlendioxid und Wasser in Glukose und Sauerstoff umwandeln. Chlorophyll ist das Schlüsselmolekül in diesem Prozess, dessen chemische Reaktion lautet:
Licht + 6co2 + H2O → c6H12ENTWEDER6 + 62
Wie zu sehen ist, ist es die umgekehrte Reaktion des Atmens. Um ein Kilogramm Glukose zu produzieren, werden 15 Mega -Joule Sonnenenergie benötigt.
2. Wasser kochen und kochen
Eine sehr häufige Reaktion, die Energie zum Vorgehen erfordert, ist das kochende Wasser:
H2O (Flüssigkeit) + Energie → h2O (Dampf)
Nahrungsmittel erfordern normalerweise Wasser zum Kochen, und auf die gleiche Weise muss das Wasser, das sie enthalten.
3. Das Eis schmelzen
In ähnlicher Weise ist es üblich, dass Eis bei Raumtemperatur schmilzt, wenn dies größer als 0 ° C ist:
H2O (fest) + Energie → h2O (Flüssigkeit)
Daher kühlt das Getränk beim Hinzufügen von Eis ab, da es die Energie absorbiert, die erforderlich ist, um den Zustand aus der Flüssigkeit zu ändern.
4. Kalte Taschen
Sie werden verwendet, um Blutergüsse und Schläge zu behandeln. Enthalten Wasser und eine Hülle mit Ammoniumchlorid. Beim Klopfen auf den Beutel ist die Umschlag gebrochen und die Reaktion von Ammoniumchlorid mit Wasser, das endotherm ist, kühlt den Beutel ab und lindert die Schmerzen.
5. Ozonproduktion
Ultraviolette Strahlung aus der Sonne verwandelt Sauerstoff in Ozon und setzt dabei Wärme frei.
32 (Gas) + Ultraviolettes Licht → 23 (Gas)
Verweise
- Byju. Unterschied zwischen eDothermischen und exothermen Reaktionen. Von Byjus geborgen.com
- Chang, R. (2013). Chemie. 11va. Auflage. McGraw Hill Education.
- Grelan. Exotherme Reaktionen auf die Erhitzen von Dingen. Erholt von: Grelane.com.
- Hein, m. (2014). Grundlagen der College -Chemie. Wiley.
- Helmestine, a. Verständnis von endothermen und exothermen Reaktionen. Erholt von: thoughtco.com

