Chemische Reaktionen Eigenschaften, Teile, Typen, Beispiele

- 1682
- 298
- Jasmine Kupprion
Der chemische Reaktionen Es sind Veränderungen, die Materie unter der Reihenfolge ihrer Atome leiden, und finden statt, wenn zwei verschiedene Substanzen oder Verbindungen in Kontakt kommen. Bei dem Prozess ändert sich, die sofort wahrgenommen werden können; wie ein Anstieg der Temperatur, Kühlung, Gasbildung, Blitze oder Ausfällung eines Feststoffs.
Die häufigsten chemischen Reaktionen bleiben im täglichen Leben oft unbemerkt. Tausende von ihnen werden in unserem Körper durchgeführt. Andere sind jedoch sichtbarer, da wir sie in der Küche ausführen können, indem wir korrekte Utensilien und Zutaten auswählen. Zum Beispiel Bicarbonat mit Essig, Schmelzzucker in Wasser mischen oder den Coloradensaft ansättigen.
 Die Reaktion von Bicarbonat und Essig ist ein Beispiel für eine wiederkehrende chemische Reaktion in der Küche. Quelle: Kate Ter Har (https: // www.Flickr.com/fotos/katerha/5703151566)
Die Reaktion von Bicarbonat und Essig ist ein Beispiel für eine wiederkehrende chemische Reaktion in der Küche. Quelle: Kate Ter Har (https: // www.Flickr.com/fotos/katerha/5703151566) In Labors werden chemische Reaktionen üblicher und üblicher; Alle treten in Becher (Becher) oder Erlenmeyer -Flaschen vor. Wenn sie gemeinsam teilen, ist keiner einfach, da sie Kollisionen, Verbindungsbrüche, Mechanismen, Verbindungsbildung, Energie und kinetische Aspekte verbergen.
Es gibt chemische Reaktionen, die so auffällig sind, dass Fans und Wissenschaftler, die die Toxikologie von Reagenzien und einige Sicherheitsmaßnahmen kennen, in großen Maßstäben in faszinierenden Demonstrationsakten reproduzieren.
[TOC]
Chemisches Reaktionskonzept
Chemische Reaktionen finden statt, wenn das Brechen einer Verbindung (ionisch oder kovalent) vorhanden ist, so dass eine andere gebildet wird; Zwei Atome oder eine Reihe von ihnen hören auf, stark zu interagieren, um neue Moleküle zu verursachen. Dank dessen können die chemischen Eigenschaften einer Verbindung, ihre Reaktivität, Stabilität mit dem, was sie reagiert, bestimmt werden.
Neben der Verantwortung der chemischen Reaktionen, die sich die Angelegenheit ständig ohne ihre Atome verwandelt, erklären sie die Entstehung der Verbindungen wie wir sie kennen sie.
Damit die Links gebrochen sind, ist Energie erforderlich, und wenn die Links gebildet werden, wird sie freigegeben. Wenn die absorbierte Energie größer ist als die freigegebene, wird gesagt, dass die Reaktion endothermisch ist; Wir haben eine umgebende Kühlung. Wenn die vorliegende Wärme dem Absorbing überlegen ist, ist es eine exotherme Reaktion; Die Umgebung ist erhitzt.
Eigenschaften chemischer Reaktionen
Kinetik
Die Theorie -Moleküle müssen miteinander zusammenarbeiten und genug kinetische Energie mit sich tragen, um das Brechen eines Links zu bevorzugen. Wenn Ihre Kollisionen langsam oder ineffizient sind, ist die chemische Reaktion kinetisch betroffen. Dies kann entweder durch die physikalischen Zustände der Substanzen oder durch die Geometrie oder Struktur derselben geschehen.
In einer Reaktion wird die Materie daher durch Absorbieren oder Freisetzung von Wärme transformiert, während Kollisionen leiden, die die Bildung von Produkten bevorzugen; Die wichtigsten Komponenten einer chemischen Reaktion.
Massenschutz
Aufgrund des Massenschutzgesetzes bleibt die Gesamtmasse des Satzes nach einer chemischen Reaktion konstant. Somit ist die Summe der einzelnen Massen jeder Substanz gleich der Masse des erhaltenen Ergebniss.
Körperliche Veränderungen und/oder Zustandsänderungen
Das Auftreten einer chemischen Reaktion kann von einer Änderung des Zustands der Komponenten begleitet werden; das heißt eine Variation des festen, flüssigen oder gasförmigen Zustands des Materials.
Nicht alle Änderungen des Zustands implizieren jedoch eine chemische Reaktion. Zum Beispiel: Wenn das Wasser aufgrund von Wärme verdunstet, bleibt der nach dieser Zustandsänderung erzeugte Wasserdampf Wasser Wasser.
Farbvariation
Unter den physikalischen Eigenschaften, die sich aus einer chemischen Reaktion ergeben, sticht die Änderung der Farbe der Reagenzien gegenüber der Farbe des Endprodukts aus.
Dieses Phänomen ist bei der Beobachtung der chemischen Reaktion von Metallen mit Sauerstoff angenehm.
Gasfreisetzung
Diese Eigenschaft manifestiert sich als sprudelnder oder mit der Emission bestimmter Gerüche.
Im Allgemeinen erscheinen Blasen als Folge der Unterwerfung einer Flüssigkeit bei hohen Temperaturen, was zu einer Erhöhung der kinetischen Energie der Moleküle fördert, die Teil der Reaktion sind.
Temperaturänderungen
Für den Fall, dass Wärme ein Katalysator der chemischen Reaktion ist, wird im Endprodukt eine Temperaturänderung induziert. Daher kann der Wärmeeintritt und der Ausgang im Prozess auch ein Merkmal chemischer Reaktionen sein.
Teile einer chemischen Reaktion
Reagenzien und Produkte
Eine chemische Reaktion wird durch eine Gleichung des Typs dargestellt:
A + B → C + D
Wo a und b die Reaktanten sind, während C und D die Produkte. Die Gleichung zeigt uns, dass das Atom oder das Molekül A mit B reagiert, um Produkte C und D zu verursachen. Dies ist eine irreversible Reaktion, da Reaktanten nicht von den Produkten stammen können. Stattdessen ist die folgende Reaktion reversibel:
A + B C + D
Es ist wichtig zu betonen, dass die Masse der Reaktanten (A+B) gleich der Masse der Produkte sein muss (C+D). Andernfalls würde der Teig nicht erhalten. Ebenso muss die Anzahl der Atome für ein bestimmtes Element vor und nach dem Pfeil gleich sein.
Über dem Pfeil zeigt einige Spezifikationen der Reaktion an: die Temperatur (δ), die Inzidenz von ultraviolettem Strahlung (Hv) oder der verwendete Katalysator.
Kann Sie dienen: UhrglasReaktionsmittel
In Bezug auf Leben und Reaktionen, die in unserem Körper auftreten, ist das Reaktionsmedium wässrig (AC). In jedem flüssigen Medium können jedoch chemische Reaktionen entwickelt werden (Ethanol, Gletscher Essigsäure, Toluol, Tetrahydrofuran usw.) Solange die Reagenzien gut aufgelöst sind.
Behälter oder Reaktoren
Kontrollierte chemische Reaktionen treten in einem Behälter auf, sei es ein einfaches Glasmaterial oder in einem Edelstahlreaktor.
Arten von chemischen Reaktionen
Die Arten chemischer Reaktionen basieren auf dem, was auf molekularer Ebene geschieht. Welche Links brechen und wie die Atome schließen. Es wird auch berücksichtigt, ob Arten Elektronen gewinnen oder verlieren; Auch wenn dies bei den meisten chemischen Reaktionen auftritt.
Hier sind die verschiedenen Arten von chemischen Reaktionen, die existieren.
- Oxidationsreduzierung (Rédox)
Kupferoxidation
Im Beispiel der Patina findet eine Oxidationsreaktion statt: Metallic Kupfer verliert Elektronen in Gegenwart von Sauerstoff, um sich in sein entsprechendes Oxid zu verwandeln.
4cu (s) + o2(g) => cu2Du)
Kupferoxid (i) oxidiert weiterhin, um Kupferoxid (II) zu ergeben:
2cu2Oder (s) + oder2 => 4cuo (s)
Diese Art der chemischen Reaktion, bei der die Spezies ihre Oxidationszahl (oder den Status) erhöhen oder verringert, wird als Oxidations- und Reduktionsreaktion (Rédox) bezeichnet.
Metallisches Kupfer mit Oxidationszustand 0, verliert zuerst ein Elektron und dann das zweite (oxidiert), während Sauerstoff bleibt (es ist reduziert):
Cu => cu+ + Und-
Cu+ => Cu2+ + Und-
ENTWEDER2 + 2e- => 2nd2-
Der Gewinn oder der Verlust von Elektronen kann durch Berechnung der Oxidationszahlen für Atome in den chemischen Formeln ihrer resultierenden Verbindungen bestimmt werden.
Für cu2Oder es ist bekannt, dass es Anion hat oder, weil es ein Oxid ist oder2-, Um die neutralisierten Lasten zu halten, muss jede der beiden Kupferatome +1 Last aufweisen. Sehr ähnlich tritt bei Cuo auf.
Kupfer beim Oxidieren erlangt positive Oxidationszahlen; und Sauerstoff reduziert werden, negative Oxidationszahlen.
Eisen und Kobalt
Weitere Beispiele für Reaktionen sind unten aufgeführt. Ebenso wird ein kurzer Kommentar abgegeben, und Änderungen der Oxidationszahlen werden angegeben.
Fecl2 + Cocl3 => Fecl3 + Cocl2
Wenn die Oxidationszahlen berechnet werden, wird angemerkt, dass die des CL mit einem konstanten Wert von -1 bleiben; Nicht so, mit denen von Glauben und Co.
Auf den ersten Blick hat Eisen oxidiert, während Kobalt reduziert wurde. Wie zu wissen? Weil Eisen jetzt nicht mit zwei CL interagiert- aber mit drei, das elektronegativste Chloratom ist als Eisen und Kobalt. Andererseits passiert das Gegenteil von Kobalt: Es geht von der Interaktion mit drei CL- zu zwei von ihnen.
Wenn die vorherige Argumentation nicht klar ist, werden die chemischen Gleichungen der Nettoübertragung von Elektronen geschrieben:
Glaube2+ => Glaube3+ + Und-
CO3+ + Und- => Co2+
Deshalb Glaube2+ Es oxidiert, während der CO3+ ist reduziert.
Jod und Mangan
6kmno4 + 5ki + 18HCl => 6mncl2 + 5kio3 + 6kcl+ 9h2ENTWEDER
Die Chemikalie oben mag kompliziert erscheinen, aber es ist nicht. Das Chlor (CL)-) nicht der Sauerstoff (oder2-) Erleben Sie den Gewinn oder Verlust ihrer Elektronen. Jod und Mangan, ja.
Wenn Sie nur Verbindungen mit Jod und Mangan betrachten, haben Sie:
Ki => kio3 (Oxidationszahl: -1 bis +5, verliert sechs Elektronen)
Kmno4 => Mcl2 (Oxidationszahl: +7 bis +2, gewinnt fünf Elektronen)
Jod oxidiert, während Mangan reduziert ist. Wie man weiß, ohne zu berechnen? Weil Jod von Kalium zu drei Sauerstoff (elektronegativer) geht; Und die Mangan verliert inzwischen Wechselwirkungen mit Sauerstoff, um mit Chlor zu sein (weniger elektronegativ).
Der KI kann nicht sechs Elektronen verlieren, wenn der KMNO4 Fünf gewinnen; Deshalb muss die Anzahl der Elektronen in der Gleichung ausgeglichen werden:
5 (ki => kio3 + 6e-)
6 (kmno4 + 5e- => Mcl2)
Dies führt zu einer Nettoübertragung von 30 Elektronen.
Verbrennung
Die Verbrennung ist eine kräftige und energetische Oxidation, bei der Licht und Wärme freigesetzt werden. Im Allgemeinen beteiligt sich Sauerstoff in dieser Art von chemischer Reaktion als oxidierender oder kämpferischer Mittel; Während der Reduktionsmittel der Kraftstoff ist, der am Ende des Kontos verbrennt.
Wo es Asche gibt, gab es Verbrennung. Diese bestehen aus Kohle- und Metalloxiden; Obwohl seine Zusammensetzung logischerweise davon abhängt, was der Treibstoff war. Im Folgenden finden Sie einige Beispiele:
C (s) + o2(g) => co2(G)
2co (g) + oder2(g) => 2co2(G)
C3H8(g) + 5o2(g) => 3co2(g) + 4h2O (g)
Jede dieser Gleichungen entspricht vollständige Verbrennung; Das heißt, alle Kraftstoff reagieren mit einem Sauerstoffüberschuss, um seine vollständige Transformation zu gewährleisten.
Es sollte auch beachtet werden, dass der CO2 und h2Oder es sind gasförmige Mehrheitsprodukte, wenn kohlensäurehaltige Körper verbrennen (wie Holz, Kohlenwasserstoffe und tierische Gewebe). Es ist unvermeidlich, dass aufgrund einer Sauerstoffinsuffizienz sowie weniger sauerstoffhaltigen Gasen wie CO und nicht weniger sauerstoffhaltige Gase.
- Synthese
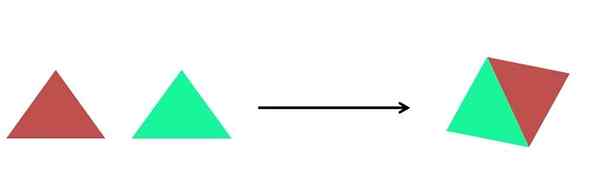
 Grafische Darstellung einer Synthesereaktion. Quelle: Gabriel Bolívar.
Grafische Darstellung einer Synthesereaktion. Quelle: Gabriel Bolívar. Im überlegenen Bild wird eine sehr einfache Darstellung gezeigt. Jedes Dreieck ist eine Verbindung oder ein Atom, das zusammenkommt, um eine einzelne Verbindung zu bilden. Zwei Dreiecke bilden ein Parallelogramm. Die Massen nehmen zu und die physikalischen und chemischen Eigenschaften des Produkts unterscheiden sich oft sehr von denen ihrer Reagenzien.
Kann Ihnen dienen: EnthalpieBeispielsweise erzeugt die Verbrennung von Wasserstoff (was auch eine Rédox -Reaktion ist) Wasserstoffoxid oder Sauerstoffhydrid; besser bekannt als Agua:
H2(g) + oder2(g) => 2h2O (g)
Durch das Mischen von beiden Gasen bei hoher Temperatur verbrennen Sie produziertes gasförmiges Wasser. Kühlte Temperaturen, Dämpfe kondensiert, um flüssiges Wasser zu ergeben. Mehrere Autoren betrachten diese Synthesereaktion als eine der möglichen Alternativen, um fossile Brennstoffe beim Erhalten von Energie zu ersetzen.
H-H und O = O-Links werden unterbrochen, um zwei neue einfache Links zu bilden: H-o-H. Wie bekannt ist, ist Wasser eine beispiellose Substanz (jenseits des romantischen Sinns), und seine Eigenschaften unterscheiden sich ziemlich stark von gasförmigem Wasserstoff und Sauerstoff.
Ionische Verbindungen
Die Bildung von ionischen Verbindungen aus ihren Elementen ist auch ein Beispiel für eine Synthesereaktion. Einer der einfachsten ist die Bildung von Metallhalgenuros der Gruppen 1 und 2. Zum Beispiel die Synthese von Calciumbromid:
Ca (s) + br2(L) => cabr2(S)
Eine allgemeine Gleichung für diese Art von Synthese ist:
M (s) + x2 => Mx2(S)
Koordinierung
Wenn die gebildete Verbindung ein metallisches Atom innerhalb der elektronischen Geometrie beinhaltet, wird gesagt, dass es ein Komplex ist. In Komplexen bleiben Metalle durch schwache kovalente Bindungen mit Liganden vereint und werden durch Koordinationsreaktionen gebildet.
Zum Beispiel haben Sie den Komplex [CR (NH)3)6]3+. Dies wird gebildet, wenn Cr -kationiert wird3+ ist in Gegenwart von Ammoniakmolekülen, NH3, die als Chromliganden wirken:
Cr3+ + 6nh3 => [Cr (NH3)6]3+
Nachfolgend finden Sie die resultierende Koordination Octaeder um das Chrommetallzentrum:
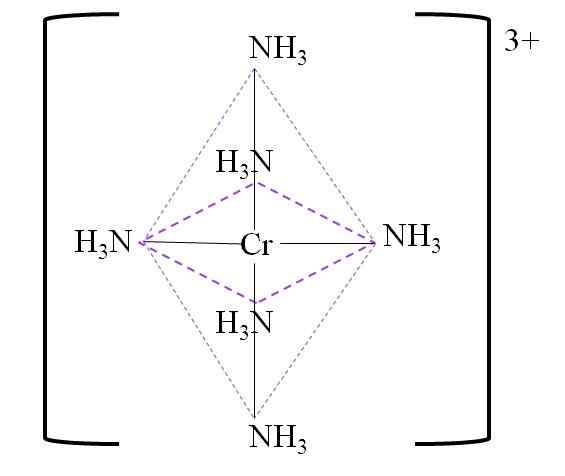 Koordination Octaeder für den Komplex. Quelle: Gabriel Bolívar.
Koordination Octaeder für den Komplex. Quelle: Gabriel Bolívar. Beachten Sie, dass die Last Chrom 3+ im Komplex nicht neutralisiert wird. Seine Farbe ist lila und deshalb ist das Oktaeder mit dieser Farbe vertreten.
Einige Komplexe sind interessanter, wie bei bestimmten Enzymen, die Eisen-, Zink- und Calciumatome koordinieren.
- Zersetzung
Die Zersetzung wird zum Gegenteil der Synthese: Eine Verbindung bricht in ein, zwei oder drei Elemente oder Verbindungen ein.
Zum Beispiel gibt es die folgenden drei Zerlegungen:
2Hgo (s) => 2Hg (l) + o2(G)
2H2ENTWEDER2(L) => 2h2Oder (l) + o2(G)
H2CO3(ac) => co2(g) + h2Oder (l)
Hgo ist ein rötlicher Feststoff, der durch Wärmewirkung in Metallquecksilber, schwarze Flüssigkeit und Sauerstoff einbricht.
Wasserstoffwasserstoffperoxid leidet unter Zerlegung und ergibt flüssiges Wasser und Sauerstoff.
Und Kohlensäure zersetzt sich inzwischen in Kohlendioxid und flüssigem Wasser.
Eine "trockenere" Zersetzung ist diejenige, die unter Metallcarbonaten leidet:
Dieb3(s) => cao (s) + co2(G)
Klassenvulkan
 Möbel Ammonium -Dichromat Vulkano. Quelle: наталия [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Möbel Ammonium -Dichromat Vulkano. Quelle: наталия [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Eine Zersetzungsreaktion, die in Chemieklassen verwendet wurde, ist die thermische Zersetzung von Ammoniumdichromat (NH4)2Cr2ENTWEDER7. Dieses orangefarbene Carcanogenalsalz (so sollte es mit großer Sorgfalt behandelt werden), verbrennt viel Wärme und erzeugt ein grünes festes Chromoxid, CR, CR2ENTWEDER3:
(NH4)2Cr2ENTWEDER7(s) => Cr2ENTWEDER3(s) + 4h2Oder (g) + n2(G)
- Verschiebung
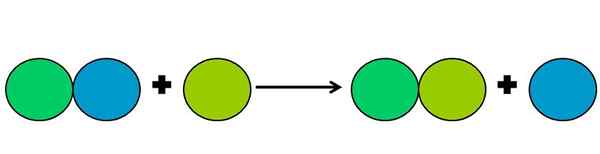 Grafische Darstellung einer Verschiebungsreaktion. Quelle: Gabriel Bolívar.
Grafische Darstellung einer Verschiebungsreaktion. Quelle: Gabriel Bolívar. Verschiebungsreaktionen sind eine Art von Reaktionsriete, bei der ein Element ein anderes in einer Verbindung verdrängt. Das verdrängte Element reduziert oder gewinnen Elektronen.
Um das obige zu vereinfachen, wird das obere Bild angezeigt. Kreise repräsentieren ein Element. Es wird beobachtet, dass der Lima Green Circle den blauen verdrängt und außen ist; Aber nicht nur das, sondern der blaue Kreis wird dabei reduziert, und der von grünem Lima wird oxidiert.
Von Wasserstoff
Zum Beispiel die folgenden chemischen Gleichungen, um die oben genannten aufzudecken:
2Al (s) + 6HCl (AC) => Alcl3(Ac) + 3h2(G)
Zr (s) + 2h2Oder (g) => zro2(s) + 2h2(G)
Zn (s) + h2SW4(ac) => ZnSO4(Ac) + h2(G)
Was ist das vertriebene Element für diese drei chemischen Reaktionen?? Wasserstoff, der auf molekularen Wasserstoff, H reduziert wird, reduziert wird2; vergeht von einer Oxidationszahl von +1 bis 0. Beachten Sie, dass Aluminium-, Zirkonium- und Zinkmetalle Wasserstoffe von Säuren und Wasser verdrängen können; Während Kupfer, Silber oder Gold nicht können.
Metalle und Halogen
Ebenso sind diese beiden zusätzlichen Verschiebungsreaktionen verfügbar:
Zn (s) + cuo4(ac) => cu (s) + znso4(Ac)
Cl2(g) + 2nai (ac) => 2nacl (ac) + i2(S)
In der ersten Reaktion verdrängt Zink das weniger aktive Metallkupfer; Zink wird oxidiert, während Kupfer reduziert wird.
In der zweiten Reaktion hingegen verdrängt Letzteres Chlor, reaktives Element als Jod, letzteres in Natriumsalz. Hier tritt rückwärts auf: Das reaktivste Element wird durch Oxidation des verdrängten Elements reduziert; Daher reduziert Chlor oxidieren auf Jod.
- Gasbildung
In den Reaktionen war zu erkennen, dass einige von ihnen Gase erzeugten und daher auch in diese Art von chemischer Reaktion eintreten. Ebenso werden die Reaktionen des vorherigen Abschnitts, die Wasserstoffverschiebung durch ein aktives Metall, als Gasbildungsreaktionen angesehen.
Kann Ihnen dienen: Dodecil Natriumsulfat (SDS): Struktur, Eigenschaften, verwendetZusätzlich zu den bereits erwähnten Metallsulfiden füllen beispielsweise Wasserstoffsulfid (die faule Eier riecht), wenn Salzsäure zugegeben wird:
N / A2S (s) + 2HCl (ac) => 2naCl (ac) + h2S (g)
- Metahese oder doppelte Vertreibung
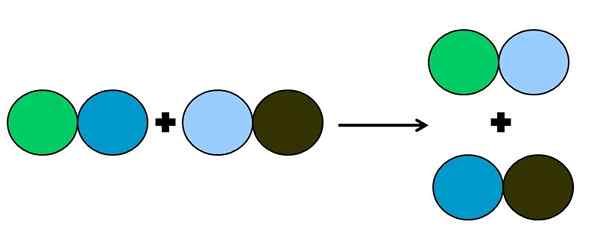 Grafische Darstellung einer doppelten Verschiebungsreaktion. Quelle: Gabriel Bolívar.
Grafische Darstellung einer doppelten Verschiebungsreaktion. Quelle: Gabriel Bolívar. Bei der Reaktion der Metathese oder der doppelten Verschiebung ist eine Änderung von Paaren ohne Elektronentransfers. Das heißt, es wird nicht als Reaktions -Rédox angesehen. Wie auf dem überlegenen Bild zu sehen ist, bricht der grüne Kreis die Verbindung mit dem von dunkelblau, um sich mit dem hellblauen Kreis zu verbinden.
Niederschlag
Wenn die Wechselwirkungen eines der Paare stark genug sind, um den Effekt des Fluid -Solversion zu überwinden, wird ein Niederschlag erhalten. Die folgenden chemischen Gleichungen repräsentieren Niederschlagsreaktionen:
Agno3(AC) + NaCl (AC) => Agcl (S) + Nano3(Ac)
CaCl2(Ac) + na2CO3(ac) => caco3(s) + 2nacl (ac)
In der ersten Reaktion die CL- verdrängt die Nr3- Silberchlorid, Agcl, ein weißer Niederschlag bildet. Und in der zweiten Reaktion das CO32- Verdrängt das Cl- Calciumcarbonat ausfällt.
Basissäure
Die vielleicht emblematischste Metathanie -Reaktionen ist die der Neutralisationsbasensäure. Schließlich werden zwei Basensäurereaktionen als Beispiele angezeigt:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Oder (l)
2HCL (AC) + BA (OH)2(Ac) => bacl2(Ac) + 2h2Oder (l)
OH- Sie bewegen sich zum CL- Wasser- und Chloridsalze bilden.
Beispiele für chemische Reaktionen
Unten und dann werden einige chemische Reaktionen mit ihren jeweiligen Gleichungen und Kommentaren erwähnt.
Verschiebung
Zn (S) + Agno3(AC) → 2AG (s) + Zn (nein3)2(Ac)
Zink verdreht Silber in seinem Nitratsalz: Es reduziert die AG+ A Ag. Infolgedessen beginnt Metallsilber in der Mitte zu fällen, die in einem Mikroskop beobachtet wird, das silberfreie Bäume. Andererseits wird Nitrat mit Zn -Ionen kombiniert2+ führt dazu, Zinknitrat zu bilden.
Neutralisation
Dieb3(s) + 2HCl (AC) → CaCl2(Ac) + h2Oder (l) + co2(G)
Salzsäure neutralisiert Calciumcarbonatsalz, um Salz, Kalziumchlorid, Wasser und Kohlendioxid zu erzeugen. Die co2 Blasen und im Wasser erkannt. Diese Bubb3.
NH3(g) + hcl (g) → nh4Cl (s)
In dieser zweiten Reaktion neutralisieren HCL das gasförmige Ammoniak. Das Salzammoniumchlorid, NH4Cl, wird wie ein weißlicher Rauch (unteres Bild) gebildet, da er sehr feine Partikel enthält, die in der Luft aufgehängt sind.
 Reaktion der Ammoniumchloridtraining. Quelle: Adam rędzikowski [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Reaktion der Ammoniumchloridtraining. Quelle: Adam rędzikowski [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Doppelte Verschiebung
Agno3(AC) + NaCl (AC) → Agcl (S) + Nano3(Ac)
In einer doppelten Verschiebungsreaktion gibt es einen Austausch von "Paaren". Silber verändert ein Paar mit Natrium. Das Ergebnis ist, dass das neue Salz, das Silberchlorid, das AgCL, wie ein milchiger Feststoff ausfällt.
Rédox
 In der chemischen Reaktion bellt Hunde Wärme, Schall und blaues Licht frei. Quelle: Maxim Bilovitskiy über Wikipedia.
In der chemischen Reaktion bellt Hunde Wärme, Schall und blaues Licht frei. Quelle: Maxim Bilovitskiy über Wikipedia. Es gibt unzählige Reaktionen Rédox. Einer der beeindruckendsten ist der von Barkin Dog:
8 n2Oder (g) + 4 cs2(L) → s8(s) + 4 co2(g) + 8 n2(G)
Die freigesetzte Energie ist so stark, wenn die drei stabilen Produkte gebildet werden, dass ein bläulicher Blitz (überlegenes Bild) und eine durchschlagende Erhöhung des durch die Gases verursachten Drucks erhöht werden (Co2 und n2).
Außerdem wird dies alles von einem sehr starken Klang begleitet, das dem Bellen eines Hundes ähnelt. Der produzierte Schwefel, s8, Abdecken Sie gelb die inneren Wände des Rohrs.
Welche Spezies ist reduziert und welche oxidiert wird? In der Regel haben die Elemente die Oxidationsnummer 0. Daher müssen Schwefel und Stickstoff in Produkten die Arten sein, die Elektronen gewonnen oder verloren haben.
Der Schwefel oxidiert (verlorene Elektronen), da es in der CS Oxidationszahl -2 hatte2 (C4+S22-):
S2- → s0 + 2e-
Während der Stickstoff reduziert wurde (gewonnene Elektronen), weil er eine Oxidationszahl +1 in n hatte2Oder (n2+ENTWEDER2-):
2n+ + 2e → n0
Löste chemische Reaktionenübungen
- Übung 1
Was Salz in der nächsten Reaktion in wässrigem Medium ausfällt?
N / A2S (ac) + feso4(Ac) →?
In der Regel werden alle Sulfide, mit Ausnahme von alkalischen und Ammoniummetallen, in wässriges Medium ausfallen. Eine doppelte Verschiebung tritt auf: Eisenbindung an Sulfid und Natrium mit Sulfat:
N / A2S (ac) + feso4(ac) → fes (s) + na2SW4(Ac)
- Übung 2
Welche Produkte erhalten wir von der folgenden Reaktion??
Briefmarke3)2 + CA (OH)2 →?
Calciumhydroxid ist in Wasser nicht sehr löslich; Die Zugabe von Kupfernitrat hilft jedoch, sie zu löschen, da es auf das entsprechende Hydroxid reagiert:
Briefmarke3)2(AC) + CA (OH)2(AC) → Cu (OH)2(s) + ca (nein3)2(Ac)
Die Cu (OH)2 Es ist sofort als blauer Niederschlag erkannt.
- Übung 3
Welches Salz wird bei der nächsten Neutralisationsreaktion auftreten?
Al (OH)3(s) + 3HCl (AC) → ¿¿¿?
Aluminiumhydroxid verhält sich wie eine Base, die mit Salzsäure reagiert. In einer Reaktion der Säure-Base-Neutralisation (aus Brnsted-Lowry) wird immer gebildet, sodass das andere Produkt Aluminiumchlorid sein muss, Alcl3:
Al (OH)3(s) + 3HCl (AC) → Alll3(Ac) + 3h2ENTWEDER
Diesmal die Alcl3 Es fällt nicht aus.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Ana Zita. (18. November 2019). Chemische Reaktionen. Erholt von: Todamateria.com
- Kashyap Vyas. (23. Januar 2018). 19 coole chemische Reaktionen, die die Prov -Wissenschaft falziniert. Erholt von: interessantgineering.com
- Beautifulchemistry.Netz (s.F.). Reaktion. Erholt von: Beautifulchemistry.Netz
- Wikipedia. (2019). Chemische Reaktion. Abgerufen von: in.Wikipedia.Org

