Senkenregel oder maximale Multiplizität

- 684
- 19
- Luca Holdt
Wir erklären, was die Heilregel oder das Prinzip der maximalen Multiplizität ist, Schritte zur Anwendung und angeben mehrere Beispiele
 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Was ist die Sink -Regel?
Der Waschbeckenregel, Auch als maximales Multiplizitätsprinzip des Spin bezeichnet, ist es eine empirische Regel, die verwendet wird, um die absolute elektronische Konfiguration der chemischen Elemente zu schreiben, wenn sie sich in ihrem grundlegenden Zustand befinden. Das heißt, es ist eine Regel, die vorhersagt.
Senks Regel sagt:
"… In einem Atom, das sich in seinem grundlegenden Zustand befindet, werden Elektronen desselben Energieniveaus so verteilt, dass es so viel wie möglich von parallelen Stacheln gibt.".
Diese Regel entspricht einem der grundlegenden Prinzipien der Quantenmechanik und der aktuellen Atomtheorie. Es ist sehr nützlich, einige Eigenschaften der verschiedenen Elemente zu verstehen, insbesondere ihrer magnetischen Eigenschaften. Dies liegt daran, dass Atome von Magneten angezogen oder abgestoßen werden, da sie Elektronen in ihrer Struktur verschwunden sind.
Woher kommt die Senk- oder maximale Multiplizitätsregel??
Atomspektren
Dieses Prinzip wurde erstmals 1927 den deutschen Physiker Friedrich -Hund ausgestuft. Sink untersuchte Atomabsorptionsspektren, die es ermöglichen, die Energie, die Elektronen absorbieren. Experimentelle Beobachtungen konnten nur erklärt werden, wenn das Atom so viele Elektronen wie möglich mit demselben Spin besaß.
Fehlende Elektronen
Zusätzlich zu den Atomspektren gibt es andere experimentelle Beobachtungen, die die elektronischen Konfigurationen bestätigen, die durch Anwendung der Hundelegel vorhergesagt werden. Das Wichtigste besteht aus den experimentellen Messungen der magnetischen Eigenschaften von Atomen, die ermöglichen, zu bestimmen, wie viele fehlende Elektronen ein Atom haben.
Es kann Ihnen dienen: WasserelektrolyseDie fehlenden Elektronen sind diejenigen, die allein in einem Orbital sind, ohne dass ihr jeweils entgegengesetztes Spinpaar.
Schritte zur Anwendung der Sink -Regel
Die Sink -Regel gilt, wenn wir die elektronische Konfiguration eines Atoms in seinen grundlegenden Zustand schreiben. Dies bedeutet, dass es sich um eine komplementäre Regel anderer Regeln handelt, wie das Aufbau -Prinzip oder das Konstruktionsprinzip (auch die Regenregel genannt) und das Prinzip des Ausschlusses von Pauli.
Gilt nur für Fälle, in denen wir wollen.
Darüber hinaus ist es nur sinnvoll, sie für die Valencia -Schicht anzuwenden, dh zu diesem unvollständigen Energieniveau (es gibt nicht alle Elektronen, die in sie passen). Andernfalls würden alle Elektronen gepaart, um Paulis Ausschlussprinzip einzuhalten.
Die Anwendung dieser Regel besteht aus den folgenden Schritten:
- Schritt 1: Zeichnen Sie eine horizontale Linie oder ein kleines Rechteck für jedes Orbital des Sub -Level.
- Schritt 2: Platzieren Sie das erste Elektron im ersten Orbital, wobei Ihr Spin nach oben zeigt.
- Schritt 3: Platzieren Sie das folgende Elektron im nächsten Orbital und zeigen ebenfalls nach.
- Schritt 4: Fahren Sie so fort, bis die Elektronen vorbei sind oder es keine leeren Orbitale mehr gibt.
- Schritt 5: Wenn bei der Platzierung eines Elektrons in jedem Orbital noch Elektronen verteilt werden müssen, wiederholen Sie die Schritte 2 bis 4, aber platzieren Sie die Elektronen mit ihrem Spin nach unten.
Um zu verstehen, wie diese Schritte gelten, analysieren wir einige Beispiele.
Beispiel 1: Stickstoffelektronische Konfiguration
Stickstoff ist Element Nummer 7, daher hat es insgesamt 7 Elektronen, die sich um den Kern drehen. Diese Elektronen werden wie folgt verteilt, nachdem sie der Regenregel:
Kann Ihnen dienen: Acetanylid (C8H9no)1s2 2s2 2 p3
Wie wir sehen können, entspricht die Stickstoffvalenzschicht dem Level 2 von Energie (Schicht L), in dem 8 Elektronen passen. Stickstoff hat jedoch nur 5 Valencia -Elektronen.
In den Orbitalen S Nur 2 Elektronen passen.
Andererseits ist der 2p -Sub -Level, der 3 Orbitale enthält, nicht voll. Aber wie werden diese 3 Elektronen in diesen drei Orbitalen verteilt?? Sie werden nach den folgenden Schritten der Sink -Regel verteilt:
Schritt 1: Zeichnen Sie eine horizontale Linie oder ein kleines Rechteck für jedes Orbital des Sub -Level.
Da es der 2p -Sub -Level ist, gibt es drei Orbitale, die die 2p sindX, 2 pUnd und die 2pz. Wir müssen also drei horizontale Streifen oder drei Kisten oder Rechtecke zeichnen:
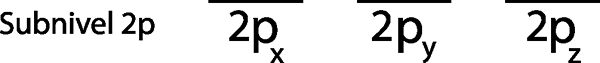
Jedes dieser Streifen oder Boxen repräsentiert ein Orbital, wie durch den Namen angezeigt.
Schritt 2: Platzieren Sie das erste Elektron im ersten Orbital, wobei Ihr Spin nach oben zeigt.
Wir platzieren das erste Elektron im 2p -OrbitalX Da dies das erste Orbital auf der Liste ist.
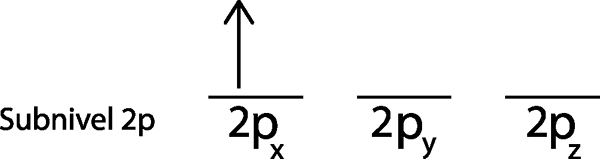
Schritt 3: Platzieren Sie das folgende Elektron im nächsten Orbital und zeigen ebenfalls nach.
Das zweite Elektron befindet sich im 2P -OrbitalUnd
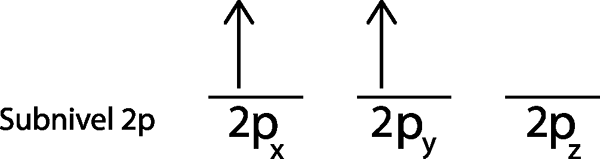
Schritt 4: Fahren Sie so fort, bis die Elektronen vorbei sind oder es keine leeren Orbitale mehr gibt.
In unserem Fall müssen wir nur 3 Elektronen verteilen, daher müssen wir nur das letzte Elektron im letzten Orbital und Voila platzieren:
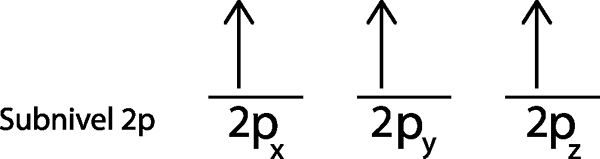
Wie zu sehen ist, sagt das Prinzip der maximalen Multiplizität oder der Sensenrecing voraus, dass Atomstickstoff 3 fehlende Elektronen haben muss.
Kann Ihnen dienen: Stickstoffoxide (NOx)In diesem Fall war es nicht erforderlich, Schritt 5 anzuwenden, da wir nach Schritt 4 ohne Elektronen zur Verbreitung gelassen wurden.
Beispiel 2: Eisenelektronische Konfiguration
Eisen ist Element 26 und seine elektronische Konfiguration lautet:
1s2 2s2 2 p6 3s2 3p6 3d6 4s2
In diesem Fall können wir feststellen, dass das Orbital mit dem höchsten Energieniveau 4S beträgt, aber da es sich um ein Übergangsmetall handelt, hat Eisen ein teilweise volles Orbital D. Dies ist das Orbital, dessen Elektronen wir nach der Hunder -Regel verteilen werden.
Schritt 1: Zeichnen Sie eine horizontale Linie oder ein kleines Rechteck für jedes Orbital des Sub -Level.
Wir werden den 3D -Sub -Level füllen, der 5 Orbitale enthält:
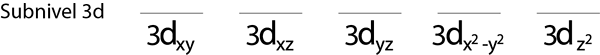
Schritt 2: Platzieren Sie das erste Elektron im ersten Orbital, wobei Ihr Spin nach oben zeigt.
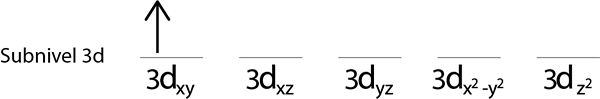
Schritte 3: Platzieren Sie das folgende Elektron im folgenden Orbital und zeigen ebenfalls nach.
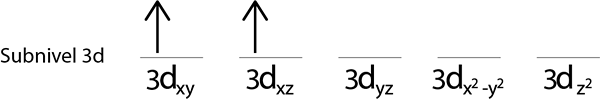
Schritt 4: Fahren Sie so fort, bis die Elektronen vorbei sind oder es keine leeren Orbitale mehr gibt.
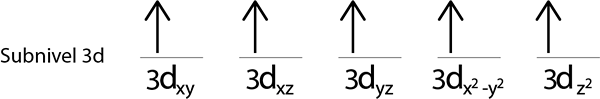
Schritt 5: Wenn bei der Platzierung eines Elektrons in jedem Orbital noch Elektronen verteilt werden müssen, wiederholen Sie die Schritte 2 bis 4, aber platzieren Sie die Elektronen mit ihrem Spin nach unten.
Da wir nach dem Platzieren eines Elektrons in jedem 3D -Orbital noch ein Elektron verteilt haben.
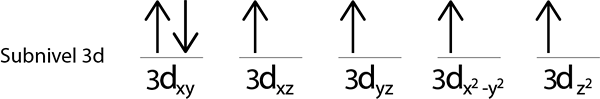
Dies ist die absolute Konfiguration eines Eisenatoms in seinem grundlegenden Zustand. Gleiches hat Eisen 4 fehlende Elektronen mit parallelen Stacheln.
Verweise
- Ohne Antwortfragen zur maximalen Multiplizität oder der Sink -Regel: Was sollte getan werden (2020). Aus den Physis und Quimica entnommen.com.
- Waschbecken - Chemie (2021). Aus costproject entnommen.Org.
- Maximale Multiplizität von Sind (2020). Aus Principiode entnommen.com.
- Waschbeckenregel | The Chemistry Guide (2012). Aus der Chemie entnommen.Laguia2000.com.

