Oktettregel

- 1297
- 132
- Joe Hartwig
 Darstellung eines Kohlendioxidmoleküls, das die Einhaltung der Oktettregel zeigt
Darstellung eines Kohlendioxidmoleküls, das die Einhaltung der Oktettregel zeigt Was ist die Oktettregel?
Der Oktettregel Es ist eine praktische Regel, die die Bildung der chemischen Bindung der repräsentativen Elemente auf der Grundlage der elektronischen Konfiguration ihrer Valenzschicht erklärt.
Nach dieser Regel verbinden sich die Atome so miteinander, dass jedes Atom von acht Elektronen in seiner Valenzschicht umgeben ist (daher das Wort Oktett).
Diese Regel wurde gleichzeitig in 1 veröffentlicht.916 Sowohl Gilbert Lewis als auch Walther Kossel. Es spiegelt die Beobachtung wider, dass edle Gase sehr stabil und alle sind, mit Ausnahme von Helium, sie sind durch ihre Valenzschicht mit 8 Elektronen gekennzeichnet.
Die Theorie legt fest, dass Atome Elektronen teilen oder austauschen, indem er chemische Bindungen bildet, um diese elektronische Konfiguration mit voller Layer zu erwerben.
Die Oktettregel und Lewis -Strukturen
Die Oktettregel und die Lewis -Strukturen sind eng miteinander verbunden. Dies liegt daran.
In diesem Sinne besteht einer der wesentlichen Schritte zum Zeichnen einer Lewis -Struktur, nachdem einfache Verbindungen zwischen allen Atomen, die das Molekül bilden.
In Fällen, in denen Oktetten ohne Füllung sind, werden doppelte oder dreifache Bindungen gebildet und suchen immer nach der Oktettregel für so viele Atome wie möglich. Diese empirische Regel ist daher für den Bau von Lewis -Strukturen von wesentlicher Bedeutung.
Es kann Ihnen dienen: Silver Yoduro (AGI): Struktur, Eigenschaften, erhalten, verwendet, verwendetBeispiele für die Einhaltung der Oktettregel
Die Oktettregel wird hauptsächlich auf die repräsentativen Elemente angewendet, dh auf die der S- und P -Blöcke der Periodenzüchtertabelle. Diese Regel wird konsequent auf Verbindungen angewendet, die Kohlenstoff, Stickstoff, Sauerstoff und Halogene sowie einige Ausnahmen von den anderen Elementen des P -Blocks enthalten. Die meisten Übergangsmetalle entsprechen jedoch nicht.
Einige Beispiele für Verbindungen, bei denen die Oktettregel für alle Atome erfüllt ist:
Kohlendioxid (CO2)
Wie in der Lewis -Struktur des nachstehend vorgestellten Kohlendioxids zu sehen ist, entsprechen sowohl der zentrale Kohlenstoff als auch beide Sauerstoffatome der Oktettregel.
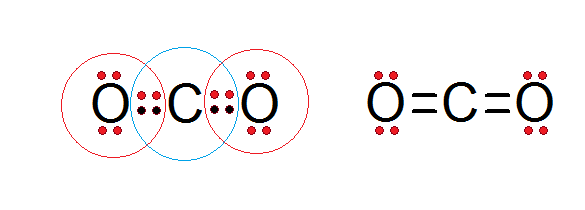
Kohlenstoff ist von seinen 4 Valenzelektronen umgeben, zwei Elektronen aus jedem Sauerstoff, die zur Bildung der Doppelbindungen c = o beitragen, während jeder Sauerstoff von 6 eigenen Elektronen plus einem Paar aus Kohlenstoff umgeben ist.
Neopentano (c5H12)
In der überwiegenden Mehrheit der organischen Verbindungen erfüllen alle Atome die Oktettregel (mit Ausnahme von Wasserstoff, der nur 2 Elektronen umgeben ist). Dies umfasst Alkane wie Neopentano oder 2,2-Dimethylpropan:
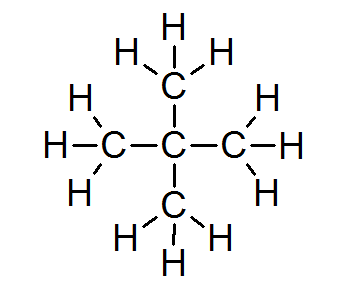
In diesem Fall ist auch ersichtlich, dass jedes Kohlenstoffatom seine vier Elektronen mit 4 benachbarten Atomen teilt, von denen jedes eines seiner Elektronen zur Bildung der 4 einfachen kovalenten Bindungen enthält, die zusammen bleiben.
Aus diesem Grund ist jedes Kohlenstoffatom von 8 Valenzelektronen umgeben, die der Oktettregel entsprechen.
Kann Ihnen dienen: AktivierungsenergieKohlenmonoxid (CO)
Kohlenmonoxid ist eine weitere molekulare Verbindung, bei der Sauerstoff und Kohlenstoff -Elektronen eine kovalente Bindung bilden, um die Oktettregel zu erfüllen.
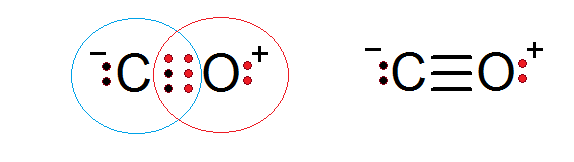
In diesem Fall liefert Carbon zwei Elektronen und Sauerstoff 4, um die 6 Elektronen zu vervollständigen. Jedes der beiden Atome hat zusätzliche Elektronen ohne teilen, die jedes Oktett vervollständigen.
Nitratanion (nein3-)
Auch bei Ionen wird die Oktettregel erfüllt. Das Nitration hat ein zentrales Stickstoffatom, das von 3 Sauerstoffatomen umgeben ist.
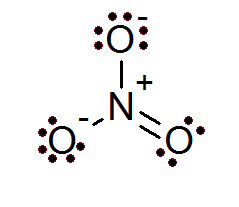
Wie in diesem Fall zu sehen ist, haben alle Atome ihren vollen Oktett, zwei des Sauerstoffs haben eine negative formale Belastung, während Stickstoff eine positive formal.
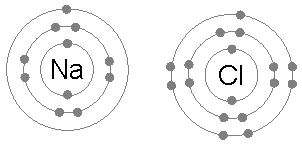
Natriumchlorid (NaCl)
Der Austausch von Elektronen zur Bildung von ionischen Verbindungen ist auch ein häufiges Beispiel für die Anwendung der Oktettregel.
Wenn Natriumchlorid aus Chlor und Natrium gebildet wird, beginnt es von zwei Atomen, die der Oktett -Regel nicht entsprechen.
Dann verleiht das Natrium Chlor sein Elektron, wobei das Kation von 8 Elektronen umgeben bleibt und das Oktett zum Chlor durch Bildung des Chloridions vervollständigt.
 Ausnahmen von der Oktettregel
Ausnahmen von der Oktettregel
So wie es eine große Anzahl von Verbindungen gibt, in denen alle Atome die Oktettregel erfüllen, gibt es auch mehrere Beispiele für Atome, die sie nicht entsprechen.
Es kann Ihnen dienen: Potential Z: Werte, Gerinnungsgrade, Bestimmung, VerwendungsmöglichkeitenEinige sind von weniger als 8 Elektronen umgeben, also sind sie also schlechte Elektronenarten, Während andere von mehr als acht Elektronen umgeben sind, wird in diesem Fall gesagt, dass es ein erweitertes Oktett hat oder genannt wird Hypervalentes Atom.
Beispiele für schlechte Elektronenarten
Bordanisch (BH3)
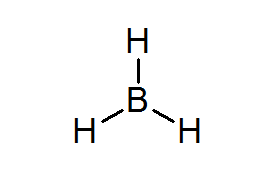
Diese Verbindung ist ein typisches Beispiel für eine schlechte Art von Elektronen. Weder Bor noch die umgebenden Wasserdünste haben über genügend Elektronen, um die Oktettregel im zentralen Atom zu erfüllen. Dies veranlasst Boron, ein paar Elektronen aus einem anderen Atom in einem anderen Molekül zu empfangen, und verwandelt die Bordeal in eine Säure von Lewis.
Aluminium -Triclurur (Alcl3)
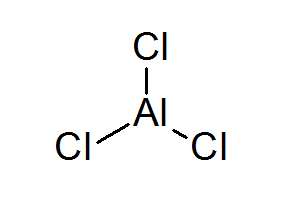
Die Alcl3 Es ist ein weiteres Beispiel für eine Lewis -Säure, die ihr chemisches Verhalten schuldet, dem sie nicht der Oktettregel entspricht.
Beispiele für hypervaluente Arten
Schwefel Hexafluoruro (SF6)
Ein typisches Beispiel für ein erweitertes Oktett ist der SF6, Dies wird normalerweise als zentraler Schwefel mit 6 einfachen kovalenten Bindungen mit Fluoratomen dargestellt. In diesem Fall ist Schwefel von 12 Valenzelektronen anstelle von 8 umgeben, sodass er gegen die Oktettregel verstößt.
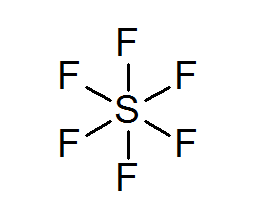
Trotzdem wurden Modelle vorgeschlagen, bei denen Schwefel tatsächlich mit kovalenten Bindungen an 4 Fluor. Wenn ja, würde es die Oktettregel erfüllen.
Phosphorpentachlorid (PCL5)
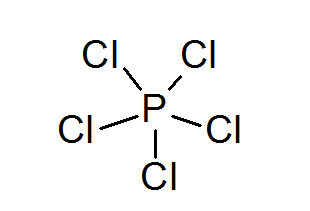
Wie im Fall von Schwefel kann Phosphor auch Verbindungen mit ausgedehnten Oktetten bilden, in diesem Fall von 10 Elektronen umgeben.

