Rubidio Historia, Eigenschaften, Struktur, erhalten, verwendet, verwendet

- 2124
- 115
- Ibrahim Steuk
Er Rubidium Es handelt. Sein Name klingt wie Rubí, und das liegt daran, dass er, als sein Emissionsspektrum entdeckt wurde.
Es ist eines der reaktivsten Metalle, die existieren. Es ist das erste der alkalischen Metalle, die, obwohl sie wenig dicht sind, ins Wasser sinken. Es reagiert auch mit ihr explosiver im Vergleich zu Lithium, Natrium und Kalium. Es gab Experimente, in denen die Ampullen gespeichert werden (niedrigeres Bild), um in Badewannen zu fallen und zu explodieren.
 Ampulle mit einem Gramm Rubidium, das unter einer inerten Atmosphäre gespeichert ist. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Ampulle mit einem Gramm Rubidium, das unter einer inerten Atmosphäre gespeichert ist. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]] Rubidio zeichnet sich durch ein Metall aus, das teurer ist als das gleiche Gold; Nicht so sehr für seinen Mangel, sondern für seine breite mineralogische Verteilung in der Erdkruste und die Schwierigkeiten, die beim Isolieren von Kalium und Hörverbindungen auftreten.
Es zeigt eine klare Tendenz, sich mit Kalium in seinen Mineralien zu verbinden und als Verunreinigungen zu finden. Nicht nur in geochemischer Materie bildet ein Duo mit Kalium, sondern auch im Bereich der Biochemie.
Der Organismus "verwirrt" die K -Ionen+ Für die von RB+; Rubidio ist jedoch bisher kein wesentliches Element, da es nicht bekannt ist, welche Rolle er im Stoffwechsel spielt. Trotzdem wurden Rubidium -Nahrungsergänzungsmittel verwendet, um bestimmte Erkrankungen wie Depressionen und Epilepsie zu lindern. Andererseits feuern beide Ionen eine violette Flamme in der Hitze des Feuerzeugs ab.
Aufgrund seiner hohen Kosten basieren seine Anwendungen nicht zu stark auf der Synthese von Katalysatoren oder Materialien, sondern als Komponente für verschiedene Geräte mit physikalischen theoretischen Basen. Einer von ihnen ist die Atomuhr, Solarzellen und Magnetometer. Deshalb wird das Rubidium manchmal als unterschätztes oder wenig untersuchtes Metall genommen.
[TOC]
Geschichte
Der Rubidio wurde 1861 von deutschen Chemikern Robert Bunsen und Gustav Kirchhoff unter Verwendung der Spektroskopie entdeckt. Zu diesem Zweck verwendeten sie das Bunsen Leichter und das Spektroskop, die zusätzlich zu den analytischen Niederschlagstechniken zwei Jahre zuvor erfunden haben. Sein Studienobjekt war das Lepidolith -Mineral, dessen Sammlung von Sachsen, Deutschland zeigt.
Sie begannen mit 150 kg Lepidolith -Mineral, die sie mit Chloroplatinsäure behandelten, H2Ptcl6, Um das Kaliumhexacloroplatinat zu fällen, k2Ptcl6. Als sie jedoch ihr Spektrum untersuchten, indem sie es im Bunsen -Feuerzeug verbrannten, stellten sie fest, dass sie Emissionslinien zeigten, die bis dahin nicht mit einem anderen Element übereinstimmten.
Das Emissionsspektrum dieses neuen Elements ist durch zwei gut definierte Linien im roten Bereich gekennzeichnet. Deshalb wurde er mit dem Namen "Rubidus" getauft, was "dunkelrot" bedeutet. Dann gelang es Bunsen und Kirchhoff, die RB zu trennen2Ptcl6 von k2Ptcl6 durch fraktionierte Kristallisation; Um es endlich mit Wasserstoff auf Ihr Chloridsalz zu reduzieren.
Identifiziert und isoliert ein Salz des neuen Rubidio -Elements, mussten deutsche Chemiker nur auf ihren metallischen Zustand reduzieren. Um dies zu erreichen, versuchten sie zwei Möglichkeiten: Die Elektrolyse auf Rubidiumchlorid auftragen oder ein leichtes Salz erhitzen, um zu reduzieren, wie z. B. Tartrato. So wurde das metallische Rubidio geboren.
Physikalische und chemische Eigenschaften
Aussehen
Silbergraues Metall. Es ist so weich, dass es wie eine Butter aussieht. Es ist normalerweise in Glasampullen gepackt, in der eine inerte Atmosphäre vorherrscht, die sie vor der Reaktion mit Luft schützt.
Atomnummer (z)
37
Molmasse
85.4678 g/mol
Schmelzpunkt
39 ºC
Siedepunkt
688 ºC
Dichte
Bei Raumtemperatur: 1.532 g/cm3
Am Schmelzpunkt: 1,46 g/cm3
Die Dichte des Rubidiums ist der des Wassers überlegen, so dass es sinkt, während er heftig damit reagiert.
Fusionshitze
2.19 kJ/mol
Verdampfungswärme
69 kJ/mol
Elektronegativität
0,82 auf der Paulingskala
Elektronische Affinität
46,9 kJ/mol
Ionisationsenergien
-Erstens: 403 kJ/mol (RB+ gasförmig)
-Zweitens: 2632.1 KJ/Mol (RB2+ gasförmig)
-Dritter: 3859,4 kJ/mol (RB3+ gasförmig)
Atomradio
248 Uhr (empirisch)
Wärmeleitfähigkeit
58,2 W/(m · k)
Elektrischer widerstand
128 nΩ · m bei 20 ° C
Mohs Härte
0,3. Daher ist auch Talk schwieriger als Metallic Rubidium.
Reaktivität
 Flammenprobe für Rubidium. Wenn er reagiert, verabschiedet er sich von einer violetten Flamme. Quelle: didaktische.Medien [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Flammenprobe für Rubidium. Wenn er reagiert, verabschiedet er sich von einer violetten Flamme. Quelle: didaktische.Medien [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Rubidio ist nach Cesio und Francio eines der reaktivsten alkalischen Metalle. Er ist kaum der Luft ausgesetzt zu verbrennen, und wenn er schlundfroh ist, schießt er leuchtende Funken. Wenn er erhitzt ist, gibt er auch eine violette Flamme (überlegenes Bild) aus, was ein positiver Test für RB -Ionen ist+.
Kann Ihnen dienen: Ididio 192Reagiert mit Sauerstoff, um eine Mischung von Peroxiden (RB) zu bilden2ENTWEDER2) und Superoxide (rbo2). Obwohl es nicht mit Säuren und Basen reagiert, verstößt es mit Wasser und erzeugt Rubidium und Wasserstoffgashydroxid:
Rb (s) + h2Oder (l) => rboh (ac) + h2(G)
Reagiert mit Wasserstoff, um seinen entsprechenden Hydrid zu bilden:
Rb (s) + h2(g) => 2RBH (s)
Und auch mit Halogenen und Schwefel explosionsartig:
2RB (s) + cl2(g) => rbcl (s)
2RB (s) + s (l) => rb2H.H)
Obwohl Rubidium nicht als giftiges Element angesehen wird, ist es potenziell gefährlich und stellt Brandrisiken dar, wenn es mit Wasser und Sauerstoff in Kontakt kommt.
Elektronische Struktur und Konfiguration
Rubidio -Atome sind so angeordnet, dass sie eine kubische Strukturkristallin im Körper (BCC) einrichten. Diese Struktur ist charakteristisch für alkalische Metalle, die Licht sind und dazu neigen, über Wasser zu schweben. mit Ausnahme des Rubidiums nach unten (Cesio und Francio).
In Rubidio BCC -Kristallen interagieren ihre RB -Atome dank der metallischen Verbindung miteinander. Dies wird von einem „Meer von Elektronen“ seiner Valenzschicht aus dem 5S -Orbital gemäß seiner elektronischen Konfiguration bestimmt:
[KR] 5S1
Alle 5S -Orbitale mit ihrem einzigen Elektron überlappen in allen Abmessungen von Rubidio -Metallkristallen. Diese Wechselwirkungen sind jedoch schwach, da die Orbitale, wenn die Gruppe alkalischer Metalle abgefeuert wird, diffuser werden und daher die metallische Verbindung schwächt.
Deshalb beträgt der Schmelzpunkt des Rubidiums 39 ºC. Auch seine schwache Metallbindung erklärt die Weichheit seiner Feststoff; So weich, dass es eine silberne Butter zu sein scheint.
Es gibt nicht genügend bibliografische Informationen über das Verhalten ihrer Kristalle unter hohem Druck. Wenn es dichteste Phasen mit einzigartigen Eigenschaften gibt, wie bei Natrium.
Oxidationszahlen
Seine elektronische Konfiguration zeigt einmal an, dass das Rubidium stark sein einziges Elektron verliert, um isolektronisch bis edelgas Kripton -Gas zu werden. Wenn dies der Fall ist, wird das monovalente Kation RB gebildet+. Es wird gesagt, dass es in seinen Verbindungen eine Oxidationszahl +1 hat, wenn die Existenz dieses Kationen angenommen wird.
Aufgrund des Trends des Rubidiums zum Oxidieren der Annahme, dass es RB -Ionen gibt+ In seinen Verbindungen ist es erfolgreich, was wiederum den ionischen Charakter dieser Verbindungen zeigt.
In fast allen Verbindungen des Rubidiums zeigt dies eine Oxidationszahl von +1. Beispiele für sie sind die folgenden:
-Rubidchlorid, RBCL (RB+Cl-)
-Rubidio Hydroxid, RBOH (RB+ Oh-)
-Rubidio Carbonat, RB2CO3 (RB2+CO32-)
-Rubidio Monoxid, RB2Oder (rb2+ENTWEDER2-)
-Rubidium Superoxid, RBO2 (RB+ENTWEDER2-)
Auch wenn es sehr selten ist, könnte das Rubidium eine negative Oxidationszahl haben: -1 (RB)-). In diesem Fall würden wir über ein "Rubidiuro" sprechen, wenn er eine Verbindung mit einem weniger elektronegativen Element als er bildete oder wenn er unter besonderen und strengen Bedingungen eingereicht wurde.
Cluster
Es gibt Verbindungen, bei denen jedes RB -Atom Oxidationszahlen mit Bruchwerten aufweist. Zum Beispiel in RB6Oder (rb62+ENTWEDER2-) und rb9ENTWEDER2 (RB94+ENTWEDER22-) Die positive Belastung ist auf eine Reihe von RB -Atomen (Cluster) verteilt. So im RB6Oder die Oxidationszahl theoretisch wäre +1/3; während in RB9ENTWEDER2, + 0,444 (4/9).
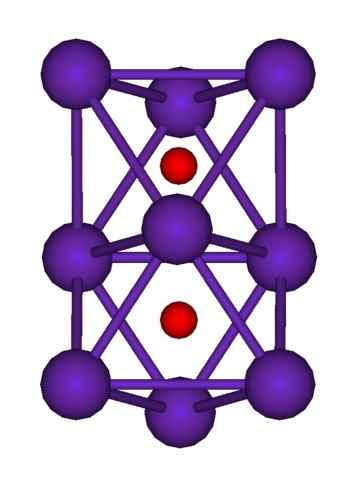 RB9O2 -Clusterstruktur. Quelle: Axiosaurus [Public Domain]
RB9O2 -Clusterstruktur. Quelle: Axiosaurus [Public Domain] Die RB -Clusterstruktur ist oben gezeigt9ENTWEDER2 dargestellt durch ein Kugeln- und Balkenmodell. Beachten Sie, wie die neun RB -Atome die Anionen einschließen oder "2-.
Durch die Erleichterung ist es, als ob ein Teil der Originalmetallkristalle des Rubidiums unverändert blieb, während sie sich vom Mutterkristall trennt. Sie verlieren dabei Elektronen; die notwendig, um das oder anzuziehen2-, und die daraus resultierende positive Ladung wird auf alle Atome dieses Cluster verteilt (Set oder Aggregate von RB -Atomen).
Somit kann in diesen Rubidiumclustern die Existenz von RB nicht formell angenommen werden+. Die RB6Oder und rb9ENTWEDER2 Sie klassifizieren als Rubidium -Suboxide, bei denen diese scheinbare Anomalie als Überschuss an Metallatomen in Bezug auf Oxideanionen erfüllt ist.
Wo ist es und erhalten
Erdkruste
 Lepidolith -Mineralprobe. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Lepidolith -Mineralprobe. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Rubidio ist das am häufigsten vorkommende Element 23 der Erdkruste mit einer Überfluss. Das Detail besteht.
Kann Ihnen dienen: Grignard -Reagenz: Vorbereitung, Anwendungen, BeispieleAus diesem Grund ist Rubidio ein sehr teures Metall, sogar mehr als das gleiche Gold, da sein Prozess, aus seinen Menas zu erhalten, aufgrund der Schwierigkeit seiner Ausbeutung komplex ist.
In der Natur befindet sich Rubidium angesichts seiner Reaktivität nicht in einem nativen Zustand, sondern als Oxid (RB2O), Chlorid (RBCL) oder begleitet von anderen Anionen. Seine "freien" RB -Ionen+ Sie sind im Meere mit einer Konzentration von 125 µg/l sowie in den heißen Federn und Flüssen.
Unter den Mineralien der Erdkruste, die sie in einer Konzentration von weniger als 1% enthalten, haben wir:
-Leucita, K [Alsi2ENTWEDER6]
-Polucita, CS (Ja2Hallo6· NH2ENTWEDER
-Carnalita, Kmgcl3· 6h2ENTWEDER
-Zinnwaldita, Klifeal (Alsi3)ENTWEDER10(Oh, f)2
-Amazonita, PB, Kalsi3ENTWEDER8
-Petalita, lialsi4ENTWEDER10
-Biotita, K (MG, Glaube)3Alsi3ENTWEDER10(Oh, f)2
-Rubiclina, (RB, K) Alsi3ENTWEDER8
-Lepidolita, K (Li, Al)3(Ja, Al)4ENTWEDER10(F, OH)2
Geochemische Assoziation
Alle diese Mineralien haben ein oder zwei Dinge gemeinsam: Sie sind Kalium-, Cäsium- oder Lithium -Silikate oder Mineralsalze dieser Metalle.
Dies bedeutet, dass Rubidio eine starke Tendenz hat, sich mit Kalium und Cesio zu verbinden. Es kann sogar Kalium während der Kristallisation von Mineralien oder Felsen ersetzen, wie es in den Feldern der Pegmatitas auftritt, wenn sich das Magma kristallisiert. Somit ist Rubidio ein Nebenprodukt der Ausbeutung und Verfeinerung dieser Felsen und ihrer Mineralien.
Rubidio kann auch in gemeinsamen Gesteinen wie Granit, Ton und Basalt und sogar kohlenstoffhaltigen Ablagerungen sein. Von allen natürlichen Quellen repräsentiert Lepidolith sein Haupterz und aus dem es kommerziell ausgebeutet wird.
Im Carnalit hingegen kann Rubidio als RBCL -Verunreinigungen mit einem Gehalt von 0,035% gefunden werden. Und in größerer Konzentration gibt es die Ablagerungen von Polucitas und Rubiclinas, die bis zu 17% Rubidium haben können.
Die geochemische Assoziation mit Kalium ist auf die Ähnlichkeit seiner ionischen Radios zurückzuführen. Die RB+ ist größer als k+, Der Unterschied in der Größen ist jedoch kein Hindernis für den ersten, der die zweite in seinen Mineralkristallen ersetzt.
Bruchkristallisation
Egal, ob es auf Lepidolith oder Polucita oder einer der oben genannten Mineralien basiert, die Herausforderung bleibt in größerem oder geringem Grad gleich: das Rubidium vom Kalium und des Cessiums trennt; Das heißt, auf die Mischungsetrennungstechniken auftragen, die die Verbindungen oder Salze von Rubidium einerseits und die von Kalium und Cäsium andererseits ermöglichen, andererseits.
Dies ist schwierig, da diese Ionen (k)+, Rb+ und CS+) eine große chemische Ähnlichkeit teilen; Sie reagieren auf die gleiche Weise, um die gleichen Salze zu bilden, die dank ihrer Dichten und Lösungen kaum voneinander unterscheiden. Deshalb wird fraktionierte Kristallisation verwendet, damit sie langsam und kontrolliert werden können.
Zum Beispiel wird diese Technik verwendet, um eine Mischung aus Carbonaten und Alaunen von diesen Metallen zu trennen. Rekristallisationsprozesse sollten mehrmals wiederholt werden, um ultimative und freie Kristalle von koprezipitierten Ionen zu gewährleisten. Ein Rubidiumsalz, das mit K -Ionen kristallisiert+ oder cs+ auf der Oberfläche oder innen.
Modernere Techniken, wie die Verwendung eines Ionenaustauschharzes oder Kronen als komplexe Wirkstoffe, erlauben auch RB -Ionen+.
Elektrolyse oder Reduktion
Sobald es möglich war, das Rubidsalz zu trennen und zu reinigen, besteht der nächste und letzte Schritt darin, die Kationen RB zu reduzieren+ zu festem Metall. Dazu schmilzt das Salz und wird einer Elektrolyse ausgesetzt, um Rubidium in der Kathode auszufällen. oder ein starkes Reduktionsmittel wie Kalzium und Natrium wird verwendet, um schnell Elektronen zu verlieren und somit das Rubidium zu reduzieren.
Isotope
Rubidio wird auf der Erde als zwei natürliche Isotope gefunden: die 85Rb und 87Rb. Der erste hat eine Fülle von 72,17%, während der zweite von 27,83%.
Er 87RB ist dafür verantwortlich, dass dieses Metall radioaktiv ist. Die Strahlung ist jedoch harmlos und sogar für die Dating -Analyse vorteilhaft. Ihr halbes Leben (T1/2) ist 4,9 · 1010 Jahre, deren Zeitraum das Alter des Universums übersteigt. Wenn es zerfällt, wird es zum stabilen Isotop 87Herr.
Dank dessen wurde dieses Isotop zum Zeitpunkt des Alters der Mineralien und Landgesteine verwendet, die seit Beginn der Erde vorhanden sind.
Zusätzlich zu den Isotopen 85Rb und 87RB, es gibt andere synthetische und radioaktive mit variablen und viel kürzeren Lebenszeiten. Zum Beispiel er 82RB (T1/2= 76 Sekunden), 83RB (T1/2= 86,2 Tage), 84RB (T1/2= 32,9 Tage) und 86RB (T1/2= 18,7 Tage). Von allen von den, die 82RB ist am häufigsten in medizinischen Studien verwendet.
Risiken
Metall
Rubidio ist ein Metall, das so reaktiv ist, dass es in Glasampullen unter einer inerten Atmosphäre gelagert werden muss, so. Wenn die Ampulle bricht, kann das Metall in Kerosin oder Mineralöl platziert werden, um es zu schützen. Es wird jedoch den gelösten Sauerstoff in ihnen oxidieren, was zu Rubidiumperoxiden führt.
Es kann Ihnen dienen: Natriumcyanid (NACN): Struktur, Eigenschaften, Risiken, verwendetWenn es im Gegenteil beschlossen wurde, es beispielsweise auf Holz zu legen, wird es mit einer violetten Flamme brennen. Wenn es viel Feuchtigkeit gibt, wird es mit der bloßen Tatsache brennen, der Luft ausgesetzt zu werden. Wenn ein großes Stück Rubidium bei einem Wasservolumen vermieden wird, nutzt es kräftig aus und erreichte den Wasserstoff in Brand.
Daher ist Rubidium ein Metall, das manipulieren sollte, da alle seine Reaktionen praktisch explosiv sind.
Ionen
Im Gegensatz zu Metallic Rubidium, seinen RB -Ionen+ Sie stellen kein offensichtliches Risiko für Lebewesen dar. Diese in Wasser gelösten in Wasser interagieren mit den Zellen genauso wie die Kionen+.
Daher haben Rubidium und Kalium ähnlich biochemisches Verhalten; Rubidium ist jedoch kein wesentliches Element, während Kalium Ja. Auf diese Weise nennenswerte Mengen an RB+ Sie können sich in den Innenräumen der Zellen, der roten Blutkörperchen und der Eingeweide ansammeln, ohne sich negativ auf den Körper eines Tieres auswirken.
Tatsächlich wurde geschätzt, dass ein erwachsener Mann mit einer Masse von 80 kg etwa 37 mg Rubidio enthält; Und darüber hinaus führt eine Zunahme dieser Konzentration in der Größenordnung von 50 bis 100 Mal nicht zu unerwünschten Symptomen.
Jedoch überschüssige RB -Ionen+ kann am Ende zu Kionen bewegen+; Und folglich wird der Einzelne bis zum Tod sehr starke Muskelkrämpfe erleiden.
Logischerweise können Salz- oder Rubidium -Verbindungen dies sofort auslösen. Darüber hinaus kann es einfache Kontaktverbrennungen und zu den giftigsten Fluorid (RBF), Hydroxid (RBOH) und Cyanid (RBCN) von Rubidium verursachen.
Anwendungen
Gassammler
Rubidio wurde verwendet, um die Spuren von Gasen zu erfassen oder zu beseitigen, die im vakuumversiegelten Röhrchen vorhanden sein können. Genau wegen ihrer hohen Tendenz, Sauerstoff und Feuchtigkeit in ihnen zu fangen.
Pyrotechnik
Wenn Rubidio-Salze eine charakteristische violett-rot-Flamme verbrennen. Einige Feuerwerkskörper haben diese Salze in ihrer Komposition, damit sie mit diesen Farben explodieren.
Ergänzung
Rubidio -Chlorid wurde der Bekämpfung der Depression verschrieben, da Studien ein Defizit dieses Elements bei Personen, die an dieser Krankheit leiden. Es wurde auch als Beruhigungsmittel und zur Behandlung von Epilepsie verwendet.
Bose-Einstein-Kondensat
Die Isotopenatome 87RB wurde verwendet, um das erste Bose-Einstein-Kondensat zu erstellen. Dieser Zustand der Materie besteht darin.
So war der Rubidio der Protagonist dieses Triumphs im Bereich der Physik, und es waren Eric Cornell, Carl Wieman und Wolfgang Ketterle, der 2001 dank dieser Arbeit den Nobelpreis erhielt.
Tumordiagnose
Das synthetische Radioisotop 82RB verfällt durch Emission von Positronen, die verwendet werden, um sich in kaliumgereichten Geweben ansammeln; Wie diejenigen im Gehirn oder im Herzen. Es wird daher verwendet, um die Funktionalität des Herzens und das Vorhandensein möglicher Tumoren im Gehirn durch Positronenemissionstomographie zu analysieren.
Komponente
Rubidio -Ionen haben Platz in verschiedenen Arten von Materialien oder Gemischen gefunden. Zum Beispiel wurden ihre Legierungen mit Gold, Cäsium, Quecksilber, Natrium und Kalium gemacht. Es wurde zu Glas und Keramik hinzugefügt, um ihren Schmelzpunkt zu erhöhen.
In Perovskitas -Solarzellen wurden sie als wichtige Komponente hinzugefügt. Ebenso wurde der mögliche Gebrauch als thermoelektrischer Generator, Wärmeübertragungsmaterial im Weltraum, Kraftstoff in ionischen Antriebsmotoren, elektrolytisches Medium für alkalische Batterien und atomare Magnetometer untersucht.
Atomicuhren
Mit Rubidium und Aufhub wurden die berühmten Atomuhren hergestellt, sehr präzise und zum Beispiel in GPS -Satelliten verwendet, mit denen die Besitzer ihrer Smartphones ihren Standort kennenlernen können, während sie sich auf einer Straße bewegen.
Verweise
- Bond Tom. (29. Oktober 2008). Rubidium. Erholt von: Chemistryworld.com
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Rubidium. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Rubidium. Pubchem -Datenbank. CID = 5357696. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Chellan, p., & Sadler, p. J. (2015). Die Elemente des Lebens und der Medikamente. Philosophische Transaktionen. Serie A, Mathematical, Physical und Engineering Sciences, 373 (2037), 20140182. Doi: 10.1098/rsta.2014.0182
- Mai Foundation für medizinische Ausbildung und Forschung. (2019). Rubidium RB 82 (intravenöse Route). Erholt von: Mayoklinisch.Org
- Marques Miguel. (S.F.). Rubidium. Geborgen von: nautilus.Fis.UC.Pt
- James l. Farbstoff. (12. April 2019). Rubidium. Encyclopædia Britannica. Erholt von: Britannica.com
- DR. Doug Stewart. (2019). Rubidium -Element -Fakten. Chemicool. Erholt von: Chemicoolool.com
- Michael Pilgaard. (10. Mai 2017). Rubidium Chemische Reaktionen. Erholt von: Pilgaargs.com
- « Tuskegee -Experimentiergeschichte, Motive und Kritik
- Malakologiegeschichte, Praktiken, Forschung »

