Takera -Eigenschaften, Struktur, Funktionen
- 4145
- 887
- Jasmine Kupprion
Der Sakera, Es ist auch als Tabera-Isomaltase-Komplex bekannt und ist ein membranaler enzymatischer Komplex mit der α-Glycosylase-Aktivität, die zu der Gruppe umfassender Hydrolasen gehört (bestehend aus Glycosidasen und Peptidasen)).
Es ist in den Darmmikrovings vieler Landtiere wie Säugetiere, Vögel und Reptilien vorhanden. Nach verschiedenen bibliografischen Quellen sind andere akzeptierte Namen dieses Enzyms Oligo-1,6-Glucosidase, α-Methylglucosidase, Isomaltase und Oligosaccharid α-1,6-Glucosidase sind.
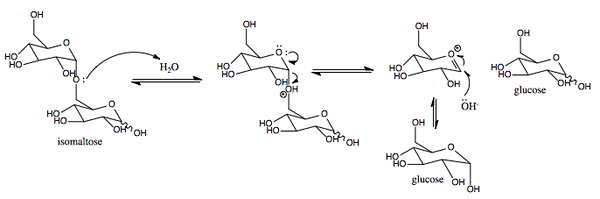
 Grafische Darstellung des Wirkungsmechanismus von SACAS.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Grafische Darstellung des Wirkungsmechanismus von SACAS.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Es ist ein Enzym mit einer ähnlichen Aktivität, die dem Invert in Pflanzen und Mikroorganismen gefunden wurde. Seine primäre Funktion besteht darin, die glucosidische Bindung zwischen Monosacchariden (Glukose und Fructose) zu hydrolysieren, aus denen die mit Nahrung aufgenommene Saccharose besteht.
Es hat sehr wichtige Verdauungsfunktionen, da Saccharose nicht als Disaccharid in Darmzellen transportiert werden kann und daher die Hydrolyse die Darmabsorption seiner konstituierenden Monosaccharide ermöglicht.
Die Synthese und Aktivität der Verusterungisomaltase in den Darmzellen der Tiere wird auf vielen Ebenen reguliert: während der Transkription und Translation, während der Glykosylierung und auch während der posttranslationalen Verarbeitung.
Wenn eines dieser Ereignisse ausfällt oder eine Art von Mutation im Gen auftritt, das es codiert, gibt es beim Menschen eine pathologische Erkrankung.
[TOC]
Eigenschaften
Die Disaccharide, die bei Säugetieren als Substrat für Säugetiere dienen. Dies liegt an der Tatsache, dass SACAs nicht nur die glucosidischen Bindungen von Saccharose, sondern auch die α-1,4.
Das halbe Leben desselben variiert zwischen 4 und 16 Stunden, sodass Darmzellen viel investieren.
Kann Ihnen dienen: Was ist die Krümmung?? (Biologie)Synthese
Wie die meisten umfassenden Hydrolase-Enzyme sind Sackwaters (Suitor-Isomaltase oder Yes) ein synthetisiertes Glykoprotein in Pinselkantenzellen wie ein Polypeptid-Vorläufer, der pro-if bezeichnet wird.
Dieses Vorläufermolekül wird auf die apikale Oberfläche der Zellen transportiert und es wird durch Pankreas -Proteasen enzymatisch verarbeitet.
Die Isomaltase-Untereinheit entspricht dem terminalen Amino-Ende des Pro-Si und hat ein hydrophobe Segment (hydrophober Anker) am N-terminalen Ende. Auf diese Weise können Sie mit der Plasmamembran von Darmzellen mit Bürstenkante assoziieren.
Das Gen, das diesen Komplex beim Menschen codiert.
Es wurde nachgewiesen, dass beide Untereinheiten, Isomaltase und SACAS, hydrolysieren können.
Struktur
Die anfängliche Form der Enzymsakas, des Pro-Si-Polypeptids, hat ungefähr 260 kDa und 1827 Aminosäuren. Die proteolytische Aktivität von Pankreas -Proteasen erzeugt jedoch zwei Untereinheiten von 140 kDa bzw. 120 kDa, die die Isomaltase bzw. Sacaras darstellen.
Dieses Enzym ist ein Glykoprotein mit Saccharid -Teilen N- Und ENTWEDER-Glycosiladas und die Studien ihrer Sequenz zeigen das Vorhandensein von mehr als 19 Glykosylierungsstellen. Kohlenhydratportionen machen mehr als 15% des Gewichts des Proteins aus und bestehen im Wesentlichen aus Sinalsäure, Galactosamin, Hand und N-Acetylglucosamin.
Kann Ihnen dienen: Leucin: Eigenschaften, Struktur, Funktionen, BiosyntheseDa die beiden Untereinheiten des Opfer-Isomaltase-Komplexes nicht genau gleich sind, sind viele Autoren der Ansicht, dass dieses Enzym in Wirklichkeit ein Heterodimer ist, bei dem jede Untereinheit aus einer glykosylierten linearen Polypeptidkette besteht und dass sie durch nicht kalvalente Verbindungen assoziiert ist.
Die Isomaltase -Untereinheit hat ein hydrophobe Segment von 20 Aminosäureabfällen, der an der Assoziation mit der Membran von Enterozyten (Darmzellen) beteiligt ist und die einen dauerhaften Anker und ein Peptidsignal darstellen, um zum endoplasmatischen Retikulum zu gehen.
Das aktive Zentrum von Untereinheiten, SACAs und Isomaltase liegt in der Plasmamembran von Enterozyten vor, die in Richtung Darmlumen hervorgehen.
Funktionen
Die wichtigsten Stoffwechselfunktionen von Enzymen wie der Freigastisomaltase hängen mit der Produktion von Glucose und Fructose aus Saccharose zusammen. Monosaccharide, die in Darmzellen transportiert und in verschiedene Stoffwechselwege mit unterschiedlichen Zwecken eingebaut werden.
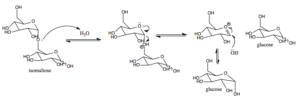 Wirkungsmechanismus der Zuckerisomaltase bei Säugetieren (Quelle: ASID3 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Wirkungsmechanismus der Zuckerisomaltase bei Säugetieren (Quelle: ASID3 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Glucose, für die es bestimmte Transporter gibt, kann beispielsweise intrazellulär in Richtung der Glykolyse gerichtet werden, wo seine Oxidation zur Energieerzeugung in Form von ATP und Reduzierung der Leistung in Form von NADH führt.
Fructose hingegen kann auch durch eine Reihe von Reaktionen metabolisiert werden. Dies beginnt die Einbeziehung dieses Substrats in andere Energieerzeugungsrouten.
Darüber hinaus hat die Zuckerisomaltaseaktivität, wie bei dem in Pflanzen umgekehrten Enzym, wichtige Auswirkungen auf zelluläre Aspekte wie osmotischer Druck, die normalerweise physiologische Ereignisse wie Wachstum, Entwicklung, Transport von Molekülen und anderen konditionieren.
Menschliche Krankheiten
Es gibt eine angeborene autosomale Erkrankung beim Menschen, die als Freier-Isomaltasa oder CSID-Mangel bekannt sind (Englisch Angeborene Lindy-Isomaltase-Defizierung), was mit Mängel in Oligo-Verdauung und osmotisch aktiven Disacchariden zusammenhängt.
Kann Ihnen dienen: GründungseffektDiese Krankheit hat mit mehreren gleichzeitigen Faktoren zu tun, unter denen die falsche Verfolgung der Pro-IF-Vorläuferform des Enzyms, genetische Mutationen, Fehler während des Transports usw.
Diese Erkrankung ist schwer zu diagnostizieren und wird oft mit einer Laktosunverträglichkeit verwechselt. Daher ist es auch als "Saccharose -Intoleranz" bekannt.
Es ist gekennzeichnet durch die Entwicklung von Bauchkrämpfen, Durchfall, Erbrechen, Jaquecas begleitet von Hypoglykämie, Mangel an Wachstum und Gewichtszunahme, Angst und übermäßiger Produktion von Gasen.
Verweise
- Brunner, j., Hauser, h., Braun, h., Wilson, k., Wecker, w., O'Neill, geb., & Semenza, G. (1979). Die Art der Assoziation des Enzymkomplexes Lygase-Isomaltase mit der Darmbürstenrandmembran. Das Journal of Biological Chemistry, 254(6), 1821-1828.
- Cowell, g., Tranum-Jensen, j., Sjöström, h., & Norén, oder. (1986). Topologie und quaternäre Struktur von Pro-Sucrase / Isomaltase und Endform Simired / Isomaltase. Journal Biochemical, 237, 455-461.
- Hauser, h., & Semenza, G. (1983). Limade-Isomaltase: Ein intrinsisches Protein der Bürstenrandmembran. Kritische Bewertungen in Bioch, 14(4), 319-345.
- Hunziker, w., Spiess, m., Semenza, g., & Lodisch, h. F. (1986). Der Limade-Lsomaltase-Komplex: Primärstruktur, Membranorientierung und Evolution eines veralteten, intrinsischen Bürstengrenzproteins. Zelle, 46, 227-234.
- Naim, h. UND., Roth, j., Sterchi, e. UND., Lentze, m., Meile, p., Schmitz, j., & Hauril, h. (1988). Lind-Isomaltase-Defizion beim Menschen. J. Klinik. Investieren., 82, 667-679.
- Rodriguez, ich. R., Taravel, f. R., & Whelan, w. J. (1984). Charakterisierung und Funktion von Schweindarm-Linde-Isomaltase und ihrer getrennten Untereinheiten. EUR. J. Biochem., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, G. (2012). Zucker. In Ullmanns Enzyklopädie der industriellen Chemie (Vol. 34, p. 72). Wiley-vch Verlag GmbH & Co. KGAA.
- GREEM, w. (1995). Angeborene Lindy-Isomaltase-Defizierung. Zeitschrift für pädiatrische Gastroenterologie und Ernährung, einundzwanzig, 1-14.
- « Gastrineigenschaften, Struktur, Produktion, Funktionen
- Die 11 Haupttypen des Ingenieurwesens und deren Merkmale »

