Grundsalzformel, Eigenschaften, Nomenklatur, Beispiele

- 3505
- 280
- Said Ganzmann
Der Basissalze Sie sind alle, die sich in Wasser auflösen, erzeugen Lösungen mit pH -Werten von mehr als 7. Dies wird durch die OH -Ionenbildung erklärt-, die direkt aus dem Auflösungsprozess oder Hydrolyse -Gleichgewicht kommen, an dem Anion teilnimmt.
Basissalze enthalten Anion OH- In ihren Feststoffen. Zum Beispiel werden alkalische Hydroxide wie Natrium und Kalium, Naoh und Koh als Mitglieder dieser Salze angesehen. Obwohl sie extrem ätzend sind, verdienen sie die Konfession von Hydroxiden, anstatt als Salze bezeichnet zu werden.
 Natriumhydroxid ist ein Beispiel für Basissalz
Natriumhydroxid ist ein Beispiel für Basissalz Andere grundlegende Salze stattdessen haben Anionen wie Carbonat, CO32-. Carbonat stammt aus Carbonsäure, H2CO3, Eine schwache Säure. Daher werden Carbonatsalze wie Calciumcarbonat, die in Antazida verwendet werden, als Basissalze klassifiziert. Die gleiche Argumentation gilt für Natriumbicarbonat, Nahco3, Und für alle anderen Bicarbonat -Salze.
Basissalze sind wichtig, da einige von ihnen die Säure der Nahrung neutralisieren können. Sie können auch verwendet werden, um Dämpfungslösungen zum alkalischen pH -Wert vorzubereiten.
[TOC]
Definitionen
Basissalze haben zwei Definitionen, die sich ergänzen: Sie enthalten OH -Anionen- In ihren Feststoffen oder erzeugen Sie dieselben Hydroxilli -Anionen, sobald sich ihre Kristalle in Wasser auflösen,.
Unabhängig von der ausgewählten Definition wird der pH -Wert seiner wässrigen Lösungen größer als 7 sein, und daher werden sie alkalisch oder grundlegend sein.
Allgemeine Formel von Basissalzen
Klar, was durch Basissalz verstanden wird, ist seine Formel, obwohl nicht streng allgemein, wie folgt:
MN(OH)WXov
Wobei M das metallische oder Ammoniumkation ist, oh die Hydroxils und Xo das von einer schwache oder starke Säure abgeleitete Anion. Die Indexs N, W Und v Wie viele m, oh und xo bzw. das Basissalz sowie ihre Proportionen machen.
Beachten Sie, dass v Es kann gleich Null sein, was bedeutet, dass wir ein alkalisches oder Alkalinoterreo -Hydroxid haben. Das passiert mit Naoh und Koh. Ebenfalls, W Es kann Null sein, was bedeutet, dass es keine Ionen gibt OH-. Zum Beispiel der Caco3 Es hat nicht oh-, Und doch bleibt es ein einfaches Salz.
Kann Ihnen dienen: Calciumsulfid (CAS): Struktur, Eigenschaften, erhalten, verwendet, verwendetAus dem obigen Abschluss wird der Schluss gezogen, dass die allgemeine Formel von Basissalzen m istN(OH)WXov, Aber nicht alle Salze entsprechen dem. Ein wichtigerer Faktor ist daher die Art des XO -Anions. Somit wird bekannt sein, wenn ein Salz grundlegend ist, unabhängig davon, ob es Ionen oh hat oder nicht- In ihren Formeln.
Basissalzeigenschaften
Basissalze lösen sich nach der folgenden Gleichung in Wasser auf:
MN(OH)WXov(s) → NM+(Ac) + WOh-(Ac) + vXo-(Ac)
Beachten Sie, dass beim Auflösen von OH -Ionen die Freilassung- im Wasser. Dies beeinflusst den pH -Wert der Lösung und wird mit einem Wert von mehr als 7 alkalisch. Zum Beispiel löst sich grundlegende Calciumnitrat im Wasser nach wie folgt:
Ca (oh) nein3(s) → ca2+(Ac) + oh-(ac) + nein3-(Ac)
Die Werte von N, W Und v Sie entsprechen 1 für dieses Salz.
Andererseits die grundlegenden Salze, die nicht OH haben-, Aber ein aus einer schwacher Säure stammender Anion ist im Wasser hydrolysiert:
Dieb3(s) → ca2+(ac) + co32-(Ac)
CO32-(Ac) + h2Oder (l) ⇌ hco3-(Ac) + oh-(Ac)
Beachten Sie, dass das Produkt dieser Hydrolyse ein OH -Anion ist-. Von dort aus liegt die Alkalität dieser Basen. Und wie erwartet sind sie jedoch weniger grundlegend als diejenigen, die bereits die Ionen haben. OH- in ihren Kristallen vorhanden. Zum Beispiel ist NaOH extrem einfach:
NaOH (s) → Na+(Ac) + oh-(Ac)
Nun, veröffentlichen Sie OH -Ionen- direkt, sobald das Wasser berührt; Oder schlimmer, berührt kaum die Hautfeuchtigkeit.
Kann Ihnen dienen: Carbokation: Bildung, Eigenschaften, Typen, StabilitätAndere physikalische oder chemische Eigenschaften von Basissalzen unterscheiden sich nicht zu sehr von denen anderer neutraler oder saurer Salze.
Nomenklatur
Die Nomenklatur von Basissalzen hängt von der Art des Anion XO ab: Wenn es monoatomisch ist oder wenn es sich um ein Oxoanion handelt. Dieser Abschnitt konzentriert sich jedoch insbesondere auf Basissalze mit OH -Anionen-. Diejenigen, die sie nicht haben, haben viel einfachere Nomenklaturen zum Auswendiglernen oder Vernunft.
Mit monoatomischen Anionen
Monoatomische Anionen sind nicht als XO dargestellt, sondern als x. Sie stammen aus einem HX -Hydracide wie Fluoridsäure, HF oder Salzsäure, HCl usw.
In diesen Fällen werden sie systematisch auf zwei Arten benannt:
(Zahlenpräfix außer dem Affen) Hydroxi + Anionenname, der mit dem Suffix -uro + -Name des Metalls mit seiner Wertigkeit in Klammern endet (wenn es mehr als einen hat)
Zum Beispiel heißt Salt Ni (OH) CL Nickel Hydroxychlorid (II).
Anionenname mit Beendigung -uro + -(Zumerprefix außer Affen) Hydroxid + Metallname und seine Wertigkeit in Klammern
Zum Beispiel kann Salz Ni (OH) CL auch als Nickelchloridhydroxid (II) bezeichnet werden.
Wir haben auch die traditionelle Nomenklatur, manchmal mit dem Systematischen gemischt:
Anionenname, gefolgt von (numerales Präfix außer dem Affen) Basis und der Name des Metalls mit den Suffixe -ooso oder -ICO wie angewendet.
Zum Beispiel heißt das Ni (OH) CL Nickel -Basic -Chlorid oder Nickelchlorid (II).
Mit Oxoanionen
Die systematische Nomenklatur für Basissalze mit Oxoanionen ist etwas komplizierter. Die einfachste Version wird jedoch wie folgt erstellt:
(Zahlenpräfix) Hydroxid- (Anionenname) + des + Metallnamens und seiner Valencia in Klammern
Zum Beispiel Glaube (OH) nein3 heißt: Hydroxid-Eisen-Nitrat (II).
Es hat auch die traditionelle Nomenklatur:
Basic Nion + (Zahlenpräfix) Name + Metallname, der in -OSO oder -ICO endet
Kann Ihnen dienen: Sauerstoff: Eigenschaften, Struktur, Risiken, verwendetAlso Glaube (oh) nein3 Es heißt: Eisenbasisnitrat oder Basis -Eisennitrat (II).
Ausbildung
Basissalze sind das Produkt von Säure-Base-Neutralisationen, insbesondere zwischen einer Hydrokaten oder einem Oxoaziden mit einem Überschuss einer Base oder eines Hydroxids:
Basis (überschüssig) + Säure → Basissalz oder alkalisch + Wasser
Zum Beispiel ca (oh) nein3 Es wird durch Neutralisierung von Salpetersäure mit einem Überschuss an Calciumhydroxid gebildet:
CA (OH)2(Überschuss) + HNO3 → ca (oh) nein3 + H2ENTWEDER
Eine andere Ausbildung des Trainings wäre wie folgt:
Glaube (OH)3(Überschüssig) + h2SW4 → fe (oh) so4 + 2H2ENTWEDER
Dieses Salz heißt: Basic II-Sulfat, Basis-Eisensulfat (III) oder Eisenhydroxidsulfat (III).
Beispiele für grundlegende Salze
 Antazida wie Calciumcarbonat, CACO3, sind Beispiele für Basissalze. Quelle: Pixabay.
Antazida wie Calciumcarbonat, CACO3, sind Beispiele für Basissalze. Quelle: Pixabay. Schließlich werden einige andere Beispiele für grundlegende Salze zusammen mit ihren einfacheren Namen aufgeführt:
-Nach3COO: Natriumacetat
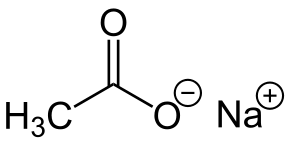 Natriumacetat
Natriumacetat -N / A2S: Natriumsulfid
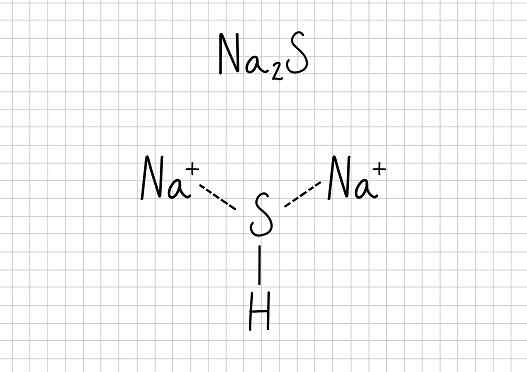 Natriumsulfid
Natriumsulfid -KCN: Kaliumcyanid
-MGCO3: Magnesiumcarbonat
-Glaube (oh) so3: Basic Iron Sulfit (III)
-Glaube (OH) (C6H5Gurren)2: Basic Iron Benzoate (III)
-Aucl (OH)2: Gold Dibasic Chlorid (III)
-Cuclo3(OH): Basic Kupferchlorat (ii)
-Bei (oh) so4: Basis -Aluminiumsulfat
-PB (OH)2CO3: Dibasic -Blei -Carbonat (IV)
Das Problem der grundlegenden Salze ist, dass nicht alle von ihnen vorbereitet werden können, da ein Überschuss an Basis oder Hydroxid nicht ausreicht, um sie zu kristallisieren, ohne auf andere Prozesse zurückzugreifen. Das ist der Fall von PB (OH)2CO3. Dieses Carbonat existiert jedoch als weißes Blei (II) -Pigment, dessen Formel 2PBCO ist3· PB (OH)2 oder pb3(OH)2(Co3)2.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Alkalisalz. Abgerufen von: in.Wikipedia.Org
- Wu c., Dowell c. & Hooper n. (1. Juli 2014). Säure-Base-Eigenschaften von Salzen. Erholt von: Chem.Librettexts.Org
- Nicola McDougal. (2020). Saure und grundlegende Salzlösungen: Erklärung & Beispiel. Lernen. Erholt von: Studium.com
- Problem- und chemische Übungen. (S.F.). Basissalze. Erholt von: Acorral.Ist
- « Konzept und Beispiele für Materialstruktur
- Gestaffelte Funktionseigenschaften, Beispiele, Übungen »

