Diazoniumsalze

- 2835
- 124
- Lewis Holzner
Wir erklären, was Diazoniumsalze sind, wie ihre Eigenschaften und Anwendungen gebildet werden
Was sind Diazoniumsalze?
Der Diazoniumsalze Sie sind organische Verbindungen, in denen es ionische Wechselwirkungen zwischen der Azo-Gruppe gibt (-n2+) Und ein Anion x- (Cl-, F-, CH3Gurren-, usw.). Die allgemeine chemische Formel ist RN2+X-, und in diesem Fall kann die Seitenkette r eine aliphatische Gruppe oder eine Arylgruppe sein; Das heißt, ein aromatischer Ring.
Im unteren Bild ist die Struktur des Arenodiazoniumions dargestellt. Die blauen Kugeln entsprechen der Azo -Gruppe, während Schwarzweiß den aromatischen Ring der Phenylgruppe ausmacht. Der az+≡N).

Es gibt jedoch Resonanzstrukturen, die diese positive Last beispielsweise im Atom des benachbarten Stickstoffs delokalisieren: -n = n+. Dies entsteht, wenn einige Elektronen, die eine Verbindung bilden, auf das Stickstoffatom links gerichtet sind.
Ebenso kann diese positive Belastung durch das PI -System des aromatischen Ringes demoziieren. Infolgedessen sind aromatische Diazoniumsalze stabiler als aliphatisch, da die positive Belastung nicht entlang einer Kohlenstoffkette abbauen kann (CH3, CH2CH3, usw.).
Ausbildung
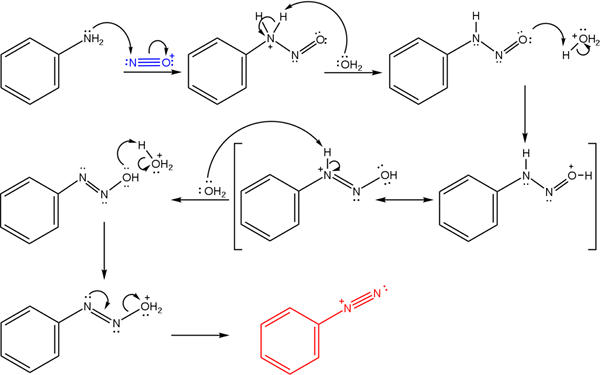
Diese Salze stammen aus der Reaktion einer primären Amina mit einem sauren Gemisch aus Natriumnitrit (Nano2).
Sekundäre Amine (r2Nh) und tertiär (r3N) Andere Stickstoffprodukte wie N-Nitrosoamin (gelbliche Öle), Aminsalze (R. R3Hn+X-) und N-Nitrosoniumverbindungen.
Das überlegene Bild zeigt den Mechanismus, durch den die Bildung von Diazoniumsalzen oder auch als Diazotisierungsreaktion bezeichnet wird.
Kann Ihnen dienen: Chrom (Cr)Die Reaktion beginnt von Phenylamin (ar-nh2), der einen nucleophilen Angriff auf das Nitrosonium -Kationatom ausführt (nein+). Dieses Kation wird durch die Nano -Mischung produziert2/Hx, wobei x normalerweise cl ist; Das heißt, HCl.
Die Bildung des Nitrosonium -Kation setzt Wasser in der Mitte frei, das ein positiv beladenes Stickstoffproton fasst.
Dann dasselbe Wassermolekül (oder andere säurespezies unterschiedlich von h3ENTWEDER+) Ergeben Sie einen Proton für Sauerstoff und demokumentieren die positive Belastung im weniger elektronegativen Stickstoffatom).
Jetzt ist das Wasser erneut ungeschützt gegen Stickstoff und produzierte dann das Diazohydroxidmolekül (das vorletzte der Sequenz).
Da das Medium sauer ist, leidet der Diazohydroxid der OH -Gruppe Dehydration; Um der elektronischen freien Stelle entgegenzuwirken, das freie Drehmoment des dreifachen Glieds der AZO -Gruppe.
Auf diese Weise bleibt am Ende des Mechanismus das Bencenodiazoniumchlorid in Lösung (C6H5N2+Cl-).
Eigenschaften
Im Allgemeinen sind Diazoniumsalze farblos und kristallin, löslich und bei niedrigen Temperaturen stabil (weniger als 5 ° C).
Einige dieser Salze sind so empfindlich gegenüber mechanischen Auswirkungen, dass jede physikalische Manipulation sie detonieren könnte. Schließlich reagieren sie mit Wasser, um Phenole zu bilden.
Verdrängungsreaktionen
Diazoniumsalze sind potentielle molekulare Stickstoff, deren Bildung der gemeinsame Nenner von Verschiebungsreaktionen ist. In diesen verdrängt eine Spezies x die instabile Azo -Gruppe und entkommt als n2(G).
Sandmeyer -Reaktion
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Gatterman -Reaktion
RNA2+ + Cux => arx + n2 + Cu+
Im Gegensatz zu Sandmeyers Reaktion hat Gattermans Reaktion Metallkupfer anstelle seines Halogenids. Das heißt, der Cux wird generiert Vor Ort.
Schiemann -Reaktion
[RNA2+] Bf4- => Arf + bf3 + N2
Kann Ihnen dienen: Ketone: Typen, Eigenschaften, Nomenklatur, Verwendungen, BeispieleSchiemanns Reaktion ist durch die thermische Zersetzung von Benzezoniumfluoroborat gekennzeichnet.
Gomberg Bachmann Reaktion
[RNA2+] Cl- + C6H6 => Ar - c6H5 + N2 + HCl
Andere Verschiebungen
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3Po2 + H2O => c6H6 + N2 + H3Po3 + HCl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Briefmarke2 => Arno2 + N2 + Cu+
Redoxreaktionen
Diazoniumsalze können auf Arilhydrazine reduziert werden, unter Verwendung einer Mischung aus CNCL2/Hcl:
RNA2+ => Arnhnh2
Sie können auch auf Arilamine reduziert werden, um mit Zn/HCL zu stärker zu reduzieren:
RNA2+ => Rnah2 + NH4Cl
Photochemische Zerlegung
[RNA2+] X- => Arx + n2
Diazoniumsalze reagieren empfindlich gegenüber Zersetzung durch Inzidenz von ultraviolettem Strahlung oder bei sehr engen Wellenlängen.
Azo -Kopplungsreaktionen
RNA2+ + Ar'h → RNA2Ar ' + h+
Diese Reaktionen sind vielleicht die nützlichsten und vielseitigsten Diazoniumsalz. Diese Salze sind schwache Elektrophile (der Ring verlagert die positive Belastung der Azo -Gruppe). Um mit aromatischen Verbindungen zu reagieren, müssen sie negativ geladen werden, wodurch Azos -Verbindungen verursacht werden.
Die Reaktion verläuft mit einer effizienten Leistung zwischen einem pH -Wert von 5 und 7. In der pH.
Auch in basischem pH -Wert (mehr als 10) reagiert Diazoniumsalz mit OH- Diazohydroxid zu produzieren, was relativ inert ist.
Strukturen dieser Art von organischen Verbindungen haben ein sehr stabiles konjugiertes PI -System, dessen Elektronen Strahlung im sichtbaren Spektrum absorbieren und emittieren.
Folglich sind Azo -Verbindungen durch farbenfrohes Bestehen gekennzeichnet. Aufgrund dieser Eigenschaft wurden sie auch azoische Farben genannt.
Kann Ihnen dienen: Molarität: Konzentration, Einheiten, Berechnung, Übungen
Das überlegene Bild veranschaulicht das Konzept der Kopplung mit der Orange von Methyl als Beispiel. In der Mitte ihrer Struktur kann die Azo -Gruppe als Stecker der beiden aromatischen Ringe beobachtet werden.
Welcher der beiden Ringe war die Elektrophie zu Beginn der Kupplung?? Der rechts, weil die Sulfonatgruppe (-so3) Entfernen Sie die elektronische Ringdichte, wodurch sie noch elektrophiler wird.
Anwendungen

Eine der kommerziellsten Anwendungen ist die Produktion von Farbstoffen und Pigmenten, die auch die Textilindustrie in Stoffstufen abdecken. Diese azoischen Verbindungen sind an bestimmten molekularen Stellen des Polymers verankert, die an Farben sterben.
Aufgrund seiner photolitischen Zersetzung wird sie (weniger als zuvor) bei der Reproduktion von Dokumenten verwendet. Als? Die von einem speziellen Kunststoff bedeckten Papierbereich.
In der organischen Synthese werden sie als Ausgangspunkte für viele aromatische Derivate verwendet.
Schließlich haben sie Anwendungen im Bereich intelligenter Materialien. In diesen ist eine Oberfläche (z.

