Haloid -Vertriebseigenschaften, Nomenklatur, wie werden sie gebildet, Beispiele

- 2022
- 635
- Frederike Birkemeyer
Der Haloidsalze Es sind binäre Verbindungen, die durch ein Metall und ein Nicht -Metall ohne andere Elemente gebildet werden. Diese Salze werden durch die Neutralisationsreaktion zwischen einer Hydracy -Säure mit einer Base gebildet. Zum Beispiel: Die Reaktion zwischen Salzsäure (HCl) mit Natriumhydroxid (NaOH) zur Bildung von Natriumchlorid (NaCl).
Haloidalsalze werden auch durch die Reaktion eines Hydrikters mit einem Metall gebildet. Zum Beispiel: die Magnesiumreaktion mit Salzsäure zur Bildung von Magnesiumchlorid (MGCL2). Chloride sind die repräsentativsten Haloidsalze. Sie sind jedoch nicht die einzigen.
 Halita, Natriumchlorid in seinem natürlichen Zustand, ist das Hauptbeispiel für ein Haloidsalz. Quelle: http: // gl.Wikipedia.org/w/Index.Php?Titel = Benutzer: Shinichi / Public Domain
Halita, Natriumchlorid in seinem natürlichen Zustand, ist das Hauptbeispiel für ein Haloidsalz. Quelle: http: // gl.Wikipedia.org/w/Index.Php?Titel = Benutzer: Shinichi / Public Domain Haloidsalze verstehen nach einigen Definitionen die Verbindungen, die sie in ihrer Halogenstruktur enthalten; Das heißt: Fluor, Chlor, Brom und Jod, daher gelten sie als gleichbedeutend mit Halogeniden oder Halogenuros.
Ebenso werden innerhalb der Haloidsalz von einigen Autoren Verbindungen enthalten, die durch die Vereinigung eines Metalls mit einem Element gebildet werden, das seine negative Wertigkeit verwendet, darunter: Carbide, Nitride, Phosphuros, Sulfide, Seleniuros, Arseniuros usw. Diese zählen auch als Haloidsalze, wenn sie gerade aus zwei Elementen bestehen.
[TOC]
Haloid -Vertriebseigenschaften
Haloidsalze sind eine Gruppe von Verbindungen, deren Eigenschaften schwer zu etablieren sind.
Starke ionische Verbindungen
Im Allgemeinen bestehen sie aus Festkörpern mit starken ionischen Bindungen zwischen Ionen zweier Elemente: M+X-, wo m+ entspricht dem metallischen Kation und x- das von nicht -metal abgeleitete Anion.
Hohe Schmelzpunkte, Kochen und Sublimation
Sie haben normalerweise eine sehr hohe Fusions-, Kochen- und Sublimationspunkte, die genau auf die Kraft seiner kristallinen Struktur zurückzuführen sind.
Es kann Ihnen dienen: DAPI (4 ', 6-Diamidino-2-fenylindol): Eigenschaften, Grundlage, VerwendungStromleitung
Im Festzustand sind sie schlechte Stromleiter, aber in wässriger Lösung, wenn sie ionisieren oder wenn sie verschmelzen, werden gute Fahrer.
Aussehen
Es handelt sich um kristalline Festkörper, die bei fragmentiertem Pulver zu einer weißen Färbung werden können. Viele Haloidsalze können jedoch eine andere Färbung haben. Zum Beispiel ist Nickelchlorid grün, während Eisenchlorid eine oszillierende Färbung zwischen Grün und Rot aufweist.
Löslichkeit
Die Mehrheit der Haluros -Salze sind in Wasser löslich, mit Ausnahme von Silber-, Blei- (II )- und Quecksilberhalogeniden (i).
Geruch
Da es sich nicht um flüchtige Verbindungen handelt, weisen Haloidsalze keine starken Gerüche auf. Aufgrund ihrer Zusammensetzung können sie auch salzige, bittere oder süße Aromen sein.
Nomenklatur
Die Haloidsalze werden benannt, indem der Name des Anion mit dem Suffix aufgebracht wird Aurochs, gefolgt von dem Namen des Metalls direkt, dem die Konjunktion vorangegangen ist von. Für den Fall, dass das Metall mehr als eine Valenz hat, wird das Metall mit dem Suffix platziert Bär oder ICO, Abhängig von seiner Valencia.
Der Name des Metalls kann auch ohne Suffix und mit der Anzahl der Oxidation in Klammern platziert werden.
Zum Beispiel: Eisenchlorid (III) oder Eisenchlorid, FECL3.
Wie entstehen Haloidsalze??
Haloidsalze werden hauptsächlich durch drei Reaktionen gebildet: Neutralisation, Säurebeaktion mit einem Metall und die Reaktion eines Metall.
Neutralisierungsreaktion
Es ist die Reaktion einer Säure mit einer Base, die Salz und ein Wassermolekül erzeugt. Zum Beispiel:
HCl +NaOH → NaCl +H2ENTWEDER
Dieses Beispiel wurde dem Prinzen erwähnt.
Reaktion einer Säure mit einem Metall
Eine starke Säure kann mit einem Metall reagieren, das ein Salz und die Freisetzung von Wasserstoff (H) entsteht2). Zum Beispiel: Salzsäure reagiert mit Zink (Zn) zu Zinkchlorid (ZNCL2):
Kann Ihnen dienen: Analytische ChemieZn +HCl → ZnCL2 + H2
Kombination eines Metalls mit einem Metall oder einem Nicht -Metall
Diese Haloidsalze resultieren aus der Kombination eines Metalls mit einem Metall oder einem Nicht -Metall von Halogenen. Zum Beispiel: Aluminium Phosphuro kombiniert Phosphor mit Valencia -3 mit Aluminium mit Valencia +3. Jetzt ist diese "Kombination" auf spezifische Produktionsreaktionen für jedes Salz zurückzuführen.
Verwendet/Anwendungen
Metall -Halogenuros
Metallhalogenuros werden in hohen Intensitätslampen wie modernen Lampen verwendet. Sie werden auch in Gewächshäusern oder Regenklima verwendet, um natürliches Licht zu ergänzen. Silberhaliden werden in Filmen und fotografischen Papieren verwendet.
Calciumchlorid
 Erscheinung von Kalziumchlorid
Erscheinung von Kalziumchlorid Kalziumchlorid wird als Kalziumquelle in der Abwasserbehandlung verwendet. Es wird auch als Kalziumquelle durch seine Elektrolyse verwendet. Es wird bei der Behandlung von Herzrhythmusstörungen und bei schwerer Hypokalzämie verwendet.
Eisenchlorid
Eisen Chlorid wird bei der Abwasserbehandlung und der Wasserreinigung verwendet. Es wird auch verwendet, um Kupfer aufzuzeichnen oder sich für Kupfer zu entscheiden und als Katalysator in den Prozess der Synthese von Vinylchlorid einzugreifen.
Chlorid- und Kaliumbromid
Kaliumchlorid wird als Dünger und bei der Behandlung von Hypokaliämie oder Hypokaliämie verwendet. Kaliumbromid hingegen wurde als antikonvulsiv verwendet und wird derzeit in der Pharmaindustrie und als Dressing verwendet.
Chlorid und Natriumsulfid
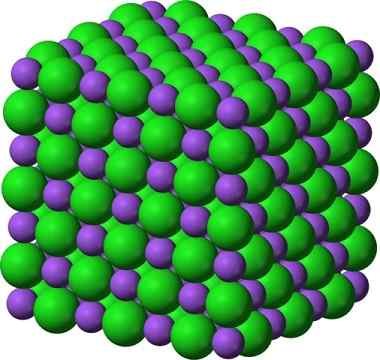
 Die kristalline Struktur von Natriumchlorid, NaCl, einer typischen ionischen Verbindung. Die __ lila Kugeln repräsentieren Natriumkationen, Na +, und die __ grünen Kugeln repräsentieren das Chlorid der Acies, Cl -.
Die kristalline Struktur von Natriumchlorid, NaCl, einer typischen ionischen Verbindung. Die __ lila Kugeln repräsentieren Natriumkationen, Na +, und die __ grünen Kugeln repräsentieren das Chlorid der Acies, Cl -. Natriumchlorid wird als Lebensmittelgeschmack bei der Erhaltung von Fleisch, als Antiseptikum bei schwerer Hyponatriämie usw. verwendet. Natriumsulfid wird in Kernreaktoren in der schweren Wasserproduktion, bei der Beseitigung von Skins -Haaren und bei der Herstellung von Gummi, Farbstoffen und Gemälden eingesetzt.
Kann Ihnen dienen: Aluminiumoxid: Struktur, Eigenschaften, Verwendungen, NomenklaturPhosphuros und Nituros
Aluminiumphosphuro wird als breites Band -Halbleiter und als Insektizid verwendet. Inzwischen wird Gallium nitruro als Halbleiter verwendet.
Beispiele für Haloidsalze
Abgesehen von den im vorherigen Abschnitt genannten Beispielen, andere Haloidsalze mit ihren jeweiligen Formeln und Namen:
-NaCl: Natriumchlorid
-KCL: Kaliumchlorid
-CaCl2: Calciumchlorid
-Mgcl2: Magnesiumchlorid
-CSCL: Cäsiumchlorid
-Bacl2: Bariumchlorid
-Fecl2: Eisen Chlorid
-Fecl3: Eisenchlorid
-Nicl2: Nickelchlorure
-Cucl: Kupferchlorid
-Cucl2: Cupric Chlorid
-AGCL: Silberchlorid
-Zncl2: Zinkchlorid
-CDCL2: Cadmiumchlorid
-Hgcl2: Mercuric Chlorid
-Alcl3: Aluminiumchlorid
-NABR: Natriumbromid
-KBR: Kaliumbromid
-CSBR: Cäsiumbromid
-CDBR: Cadmiumbromid
-Mgbr2: Magnesiumbromid
-Srbr2: Strontiumbromid (ii)
-Ki: Kalium Yoduro
-Nai: Natriumiodid
-CSI: Cäsium Yoduro
-Ali3: Aluminiumjodid
-BIP2: Bleijodid (ii)
-NAF: Natriumfluorid
-LIF: Lithiumfluorid
-CAF2: Calciumfluorid
-Ptf2: Platinfluorid (ii)
-Nas2: Natriumsulfid
-Li4C: Lithiumkarbid
-Mg2C: Magnesiumkarbid
-ALP: Aluminiumphosphuro
-Ja3N4: Silizium Nitruro
-Zinn: Titan Nitruro
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Julián Pérez Porto und María Merino. (2016). Definition von Haloidsalzen. Definition.von. Wiederhergestellt von: Definition.von
- James p. Birk. (5. Juni 2019). Halide Ins. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Wikipedia. (2020). Halogenid. Abgerufen von: in.Wikipedia.Org
- « Peroxide Eigenschaften, Nomenklatur, Verwendungen, Beispiele
- Thermohigometereigenschaften, Funktionen, Teile, verwendet »

