Bio -Salze
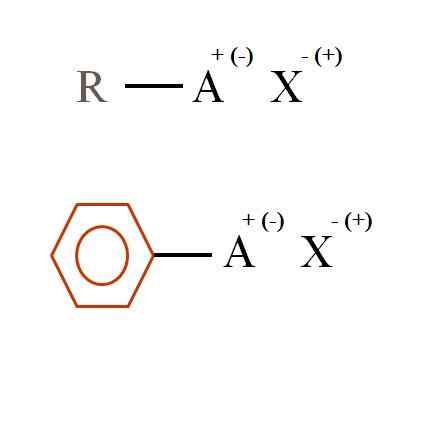
- 1275
- 307
- Joy Hort
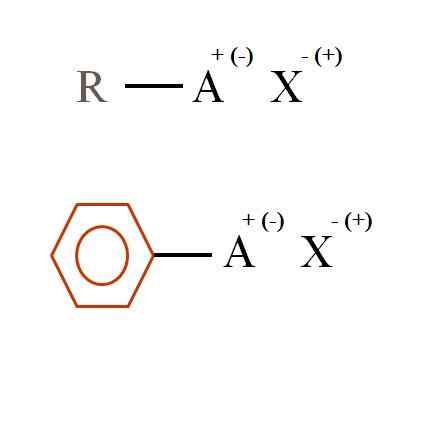 Zwei allgemeine chemische Formeln für organische Salze. Quelle: Gabriel Bolívar
Zwei allgemeine chemische Formeln für organische Salze. Quelle: Gabriel Bolívar Was sind Bio -Salze?
Der Bio -Salze Sie sind eine dichte Anzahl von ionischen Verbindungen mit unzähligen Merkmalen. Zuvor abgeleitet von einer organischen Verbindung, die eine Transformation durchlaufen hat, die es ihm ermöglicht, eine Fracht zu sein, und dass seine chemische Identität vom zugehörigen Ion abhängt.
Im überlegenen Bild sind zwei sehr allgemeine chemische Formeln für organische Salze gezeigt. Der erste, R-Ach, wird als eine Verbindung interpretiert, in deren Kohlenstoffstruktur ein Atom oder Gruppe A eine positive + oder negative Belastung trägt (-).
Wie zu sehen ist, gibt es eine kovalente Bindung zwischen R und A, R-A, aber im Gegenzug hat es eine formal. Das Lastzeichen hängt von der Art von A und der chemischen Umgebung ab.
Wenn es positiv wäre, wie viele X könnten interagieren? Mit einem, angesichts des Elektroneuteralitätsprinzips (+1-1 = 0). Was ist jedoch die Identität von x? Anion X könnte der CO sein32-, Erforderne zwei Kationen RA+; Ein Halogenid: F-, Cl-, Br-, usw.; oder sogar eine andere Verbindung-. Die Optionen sind unkalkulierbar.
Ebenso kann ein organisches Salz aromatisch sein und im Benzenen braunen Ring illustriert werden. Kupfer Benzoat Salz (ii), (c)6H5Gurren)2Cu besteht zum Beispiel aus zwei aromatischen Ringen mit negativ belasteten Carboxy -Gruppen, die mit dem Kation Cu interagieren2+.
Physikalische und chemische Eigenschaften von organischen Salzen
Aus dem Bild kann bestätigt werden, dass organische Salze aus drei Komponenten bestehen: organischer, r oder AR (der aromatische Ring), ein Atom oder Gruppenträger der ionischen Belastung A und eine Gegenion x.
Genauso wie chemische Identität und Struktur durch solche Komponenten definiert werden, hängen ihre Eigenschaften auf sie ab, wie sie von ihnen abhängen.
Aus dieser Tatsache können bestimmte allgemeine Eigenschaften, die die überwiegende Mehrheit dieser Salze entsprechen, zusammengefasst werden.
Kann Ihnen dienen: Oxidationsnummer: Konzept, wie man es herausholt und BeispieleHochmolekulare Massen
Unter der Annahme von Mono- oder vielseitigen anorganischen Anionen haben organische Salze normalerweise viel größere molekulare Massen als anorganische Salze. Dies ist hauptsächlich auf kohlensäurehaltiges Skelett zurückzuführen, dessen einfache C-C-Bindungen und seine Wasserstoffatome der Verbindung viel Masse verleihen.
Daher sind sie diejenigen, die für ihre hohen Molekularmassen verantwortlich sind.
Amphiphylisch und Tenside
Organische Salze sind amphiphile Verbindungen, dh ihre Strukturen haben sowohl hydrophile als auch hydrophobe Extreme.
Was sind solche Extreme? R oder AR repräsentieren das hydrophobe Ende, weil ihre Atome von C und H keine große Affinität zu Wassermolekülen haben.
ZU+(-), Die Atom- oder Cargo -Trägergruppe ist das hydrophile Ende, da es zum Dipolmoment beiträgt und mit dem Dipol der Wasserformung interagiert (RA)+ Oh2).
Wenn hydrophile und hydrophobe Regionen polarisiert werden, wird amphiphiles Salz zum Tensid, eine Substanz, die weit verbreitet ist Unullamping.
Hohe Siedepunkte oder Fusion
Wie anorganische Salze haben auch organische Salze aufgrund der elektrostatischen Kräfte, die in flüssiger oder fester Phase regieren, hohe Schmelz- und Siedepunkte auf.
Mit einer organischen Komponente R oder AR beteiligen sich andere Arten von Van der Waals (London, Dipolo-Dipolo, Wasserstoffbrücken) in irgendeiner Weise mit elektrostatischer Weise.
Aus diesem Grund sind die festen oder flüssigen Strukturen von organischen Salzen in erster Linie komplexer und vielfältiger. Einige von ihnen können sich sogar verhalten wie Flüssigkristalle.
Säure und Basizität
Organische Salze sind normalerweise stärker Säuren oder Basen als anorganische Salze. Dies liegt daran+-H. Spenden Sie dann in Kontakt mit einer Basis das Proton, um erneut eine neutrale Verbindung zu sein:
Es kann Ihnen dienen: Strontium: Geschichte, Struktur, Eigenschaften, Reaktionen und VerwendungRa+H + b => ra + hb
Das H gehört zu A, ist aber geschrieben, da es in die Neutralisationsreaktion interveniert.
Andererseits ra+ Es kann ein großes Molekül sein, das keine Feststoffe mit einem kristallinen Netzwerk mit Hydroxylanion oder Oxhydrilo OH bilden kann-.
Wenn dies so ist, ist der Salzbam+Oh- Es verhält sich wie eine starke Basis; Auch so einfach wie Naoh oder Koh:
Ra+Oh- + Hcl => racl + h2ENTWEDER
Hinweis in der chemischen Gleichung, dass der Anion CL- OH ersetzen-, SALT RA bilden+Cl-.
Verwendung von organischen Salzen
Die Verwendung von organischen Salzen variiert je nach Identität von R, AR, A und X. Darüber hinaus hängt die Anwendung, für die sie zugewiesen werden. Einige Allgemeinmännungen in dieser Hinsicht sind:
- Sie dienen als Reagenzien für die Synthese anderer organischer Verbindungen. Rax kann als „Geber“ der R -Kette fungieren, um eine andere Verbindung zu erweitern, die eine gute ausgehende Gruppe ersetzt.
- Sie sind Tenside, sodass sie auch als Schmiermittel verwendet werden können. Metallcarboxylalatsalze werden zu diesem Zweck verwendet.
- Sie erlauben es, eine breite Palette von Farbstoffen zu synthetisieren.
Beispiele für organische Salze
Carboxylate
Carboxylsäuren reagieren mit einem Hydroxid in einer Neutralisationsreaktion und verursachen Carboxylalatsalze: RCOO- M+; wo m+ Es kann jedes metallische Kation sein (NA+, Pb2+, K+, usw.) oder das Ammonium -NH -Kation4+.
Fettsäuren sind lange Ketten -Carboxsäuren, sie können gesättigt und ungesättigt sein. Palmitinsäure gehören zu den gesättigtem (wählen3(CH2)14Cooh). Dies entsteht das Palmitatsalz, während die Stearinsäure (Cho3(CH2)16Cooh bilden das Stearsalz. Seifen bestehen aus diesen Salzen.
Kann Ihnen dienen: Allgemeines GasrechtIm Fall von Benzoesäure, c6H5Cooh (wo c6H5- Es ist ein Benzolring), wenn es mit einer Basis reagiert. In allen Carboxilates die Gruppe -co- Repräsentiert a (Rax).
Lithium diaquilcupratos
Der Lithium -Tag ist in der organischen Synthese nützlich. Seine Formel ist [r-cu-r]-Li+, in dem das Kupferatom eine negative Belastung trägt. Hier repräsentiert Kupfer das Atom des Bildes.
Sulfoniumsalze
Sie werden aus der Reaktion eines organischen Sulfids mit einem Alkylhalogenid gebildet:
R2S + r'x => r2R's+X
Für diese Salze trägt das Schwefelatom eine positive formelle Belastung (s)+) drei kovalente Links haben.
Oxyio -Salze
Ebenso reagieren die Ether (die sauerstoffhaltigen Analoga der Sulfide) mit den Hydrrazeids, um die Sauerstoffräume zu bilden:
ROR ' + HBR RO+Hr ' + br-
Das HBR -Säure -Proton ist konsistent mit dem Ether -Sauerstoffatom (r2ENTWEDER+-H), es positiv aufladen.
Amina -Salze
Amine können primär, sekundär, tertiär oder quartär sein, genau wie ihre Salze. Alle von ihnen sind durch ein Atom von H gekennzeichnet, das mit dem Stickstoffatom verbunden ist.
So, rnh3+X- Es ist ein primäres Aminsalz; R2NH2+X-, der sekundären Amina; R3NH+X-, von tertiärem Amin; und r4N+X-, von quaternärem Amin (quaternäres Ammoniumsalz).
Diazoniumsalze
Schließlich Diazoniumsalze (RN2+X-oder Arildiazonium (RNA2+X-), sie repräsentieren den Ausgangspunkt vieler organischer Verbindungen, insbesondere der azoischen Farbstoffe.
Verweise
- Francis a. Schildpatt. Organische Chemie (Sechste Ausgabe, S. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. Organische Chemie. Amine (10. Ausgabe.). Wiley Plus.
- Wikipedia (2018). Salz (Chemie). Genommen von: in: in.Wikipedia.Org
- Steven a. Hardinger (2017). Illustriertes Glossar der organischen Chemie: Salze. Erholt von: Chem.UCLA.Edu
- Chevron Oronite (2011). Carboxylate. [PDF]. Erholt von: Oronite.com

