Sarkom
- 2084
- 356
- Luca Holdt
Was ist Sarkomer?
A Sarkom o Sarkomra ist die grundlegende funktionelle Einheit des gestreiften Muskels, dh Skelett- und Herzmuskel. Der Skelettmuskel ist die Art des Muskels, der in freiwilliger Bewegung verwendet wird, und der Herzmuskel ist der Muskel, der Teil des Herzens ist.
Zu sagen, dass Sarkomere eine funktionale Einheit ist, bedeutet, dass alle erforderlichen Komponenten für die Kontraktion in jedem Sarkomo enthalten sind. Tatsächlich besteht der gestreifte Muskel aus Millionen kleiner Sarkomer, die mit jeder Muskelkontraktion einzeln verkürzt werden.
 Mikrofrau eines Sarkomers (oben) und seiner Darstellung (unten)
Mikrofrau eines Sarkomers (oben) und seiner Darstellung (unten) Hier liegt der Hauptzweck des Sarkomeros. Sarkomere können bei der Vertragsabnahme großartige Bewegungen beginnen. Seine einzigartige Struktur ermöglicht es diesen kleinen Einheiten, Muskelkontraktionen zu koordinieren.
Tatsächlich sind die kontraktilen Eigenschaften des Muskels ein definierendes Merkmal von Tieren, da die Bewegung von Tieren bemerkenswert weich und komplex ist. Fortbewegung erfordert eine Veränderung der Muskellänge, wenn sie sich beugt, was eine molekulare Struktur erfordert, die Muskelverkürzungen ermöglicht.
Teile des Sarkomeros (Struktur)
Wenn das Skelettmuskelgewebe genau untersucht wird, wird ein zerkratztes Erscheinungsbild beobachtet. Diese "Streifen" repräsentieren ein Muster alternativer, klarer und dunkler Bänder, das verschiedenen Proteinfilamenten entspricht. Das heißt, diese Streifen werden durch unterhaltsame Proteinfasern gebildet, aus denen jedes Sarkom aus besteht.
 Illustration eines Sarkomers, der feinen, dicken Filamente und des Mechanismus der mechanischen Kontraktion sind detailliert
Illustration eines Sarkomers, der feinen, dicken Filamente und des Mechanismus der mechanischen Kontraktion sind detailliert Myofibrillen
Muskelfasern bestehen aus Hunderten bis Tausenden kontraktilen Organellen, die Myofibrillen genannt werden. Diese Myofibrillen sind parallel zur Bildung von Muskelgewebe angeordnet. Myofibrillen selbst sind jedoch im Wesentlichen Polymere, dh sich wiederholende Sarkomer -Einheiten.
Myofibrillen sind fibröse und lange Strukturen und bestehen aus zwei Arten von Proteinfilamenten, die übereinander gestapelt sind.
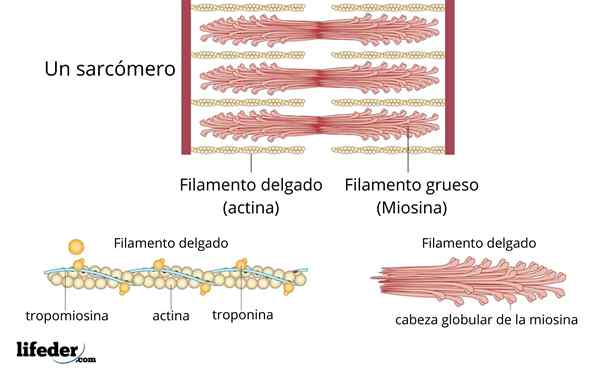
Myosin und Actin
Myosin ist eine dicke Faser mit einem kugelförmigen Kopf, und Actin ist ein dünneres Filament, das während des Muskelkontraktionsprozesses mit Myosin interagiert.
Kann Ihnen dienen: Endochondral Ossifikation: Histologie und ProzessEine gegebene Myofibrilla enthält ungefähr 10.000 Sarkomere, von denen jeweils ungefähr 3 Mikrometer lang sind. Während jedes Sarkomero klein ist, bedecken mehrere Gesamtsarkomer die Länge der Muskelfasern.
Myofilamente
Jedes Sarkom besteht aus dicken und dünnen Strahlen der oben genannten Proteine, die zusammen Myofilamente genannt werden.
Durch die Erweiterung eines Teils der Myofilamente können die Moleküle, die sie bestehen, identifiziert werden. Dicke Filamente werden aus Myosin hergestellt, während feine Filamente aus Aktin bestehen.
Actin und Myosin sind die kontraktilen Proteine, die Muskelverkürzungen verursachen, wenn sie miteinander interagieren. Darüber hinaus enthalten dünne Filamente andere Proteine mit regulatorischer Funktion als Troponin und Tropomiosin, die die Wechselwirkung zwischen kontraktilen Proteinen regulieren.
Funktionen des Sarkomers
Die Hauptfunktion des Sarkomeros besteht darin, eine Muskelzelle zusammenzuziehen zu lassen. Dazu muss das Sarkomer als Reaktion auf einen Nervenimpuls verkürzt werden.
Dicke und feine Filamente sind nicht kurz. Dieser Prozess ist als Modell der Gleitfilamente der Muskelkontraktion bekannt.
Das Gleiten des Filaments erzeugt Muskelspannungen, was zweifellos der Hauptbeitrag des Sarkomers ist. Diese Aktion gibt den Muskeln ihre körperliche Stärke.
Eine schnelle Analogie davon ist die Art und Weise, wie eine lange Leiter abhängig von unseren Bedürfnissen verlängert oder gefaltet werden kann, ohne ihre Metallteile physisch zu verkürzen.
Myosinbeteiligung
Glücklicherweise bieten jüngste Untersuchungen eine gute Vorstellung davon, wie dieser Slip funktioniert. Die Schieberfilamenttheorie wurde so modifiziert, wie Myosin in der Lage ist, Actin zu ziehen, um die Länge des Sarkomers zu verkürzen.
In dieser Theorie steht der kugelförmige Kopf von Myosin in einem Gebiet namens Region S1 nahe an Actin. Diese Region ist reich an Segmenten mit Scharnieren, die gefaltet werden können und somit die Kontraktion erleichtern.
Kann Ihnen dienen: Collector Tubulus: Eigenschaften, Funktionen, HistologieS1 -Flexion kann der Schlüssel zum Verständnis sein, wie Myosin in der Lage ist, über Actin -Filamente zu "laufen". Dies wird durch die Vereinigung des Fragments von Myosina S1, seiner Kontraktion und seiner endgültigen Veröffentlichung erreicht.
Myosin und Actiba Union
Wenn sich Myosin und Actin zusammenschließen, bilden sie Erweiterungen, die als "Kreuzbrücken" bezeichnet werden. Diese Querbrücken können gebildet und mit dem Vorhandensein (oder Abwesenheit) von ATP brechen, was das Energiemolekül ist, das die Kontraktion ermöglicht.
Wenn sich das ATP dem Actin -Filament anschließt, verschiebt es es in eine Position, die ihre Gewerkschaftsstelle Myosin aussetzt. Auf diese Weise können Myosin -kugelförmigen Kopf an dieser Website beitreten, um die Kreuzbrücke zu bilden.
Diese Vereinigung lässt die ATP -Phosphatgruppe dissoziieren, und somit beginnt Myosin ihre Funktion. Dann tritt Myosin in einen Zustand niedrigerer Energie ein, in dem Sarkomer verkürzen kann.
Um die Kreuzbrücke zu brechen und Myosin Union im nächsten Zyklus erneut Actin zu ermöglichen, ist die Vereinigung eines anderen ATP -Moleküls zu Myosin notwendig. Das heißt, das ATP -Molekül ist sowohl für die Kontraktion als auch für die Entspannung erforderlich.
Histologie
 Elektronische Mikroskopmikroprographie. Das Erscheinungsbild der Komponenten des Muskelfasersarkomers wird gezeigt. Längsschnitt (unten) und Querabschnitt (oben)
Elektronische Mikroskopmikroprographie. Das Erscheinungsbild der Komponenten des Muskelfasersarkomers wird gezeigt. Längsschnitt (unten) und Querabschnitt (oben) Die histologischen Abschnitte des Muskels zeigen die anatomischen Eigenschaften der Sarkomere. Dicke Filamente, Myosinverbindungen sind sichtbar und werden als Band A eines Sarkomeros dargestellt.
Die dünnen Filamente, Aktinverbindungen, binden an ein Protein am z (oder z) als Alpha-Actinin bezeichnet und sind über die gesamte Länge von Band I und einem Teil der Band A vorhanden.
Der Bereich, in dem sich dicke und dünne Filamente überlappen. Dieser Bereich, in dem sich dünne und dicke Filamente überlappen.
Es kann Ihnen dienen: Batropismus: Was ist es, Elektrophysiologie, physiologischer SchrittmacherDünne Filamente erstrecken sich nicht vollständig in den Bändern A und lassen einen zentralen Bereich des Bandes, der nur dicke Filamente enthält. Diese zentrale Region von Band A scheint etwas klarer als der Rest der Band A und heißt Zone H.
Die Mitte des H -Bereichs verfügt.
Die Hauptkomponenten der Histologie eines Sarkomeros sind nachstehend zusammengefasst:
Band A
Dicke Filamentzone, bestehend aus Myosinproteinen.
Zone h
Zentralbandzone A, ohne überlagerte Aktinproteine, wenn der Muskel entspannt ist.
Band i
Dünne Filamentzone, bestehend aus Aktinproteinen (ohne Myosin).
Z Discs
Sie sind die Grenzen zwischen benachbarten Sarkomeren, die durch Aktin -perpendikuläre Bindungsproteine gebildet werden.
M Linie
Zentrale Zone, die von Zubehörproteinen gebildet wird. Sie befinden sich in der Mitte des dicken Filaments von Myosin, senkrecht zum Sarkomer.
Wie oben erwähnt, tritt die Kontraktion auf. Eine entscheidende Unterscheidung, um sich zu erinnern, ist jedoch, dass sich Myofilamente an sich nicht zusammenziehen. Es ist die gleitende Aktion, die ihnen ihre Macht gibt, zu verkürzen oder zu verlängern.
Verweise
- Clarke, m. (2004). Das Schiebedfilament bei 50. Natur, 429(6988), 145.
- Hale, t. (2004) Physiologie trainieren: zum thematischen Ansatz (1. Aufl.). Wiley
- Rhoades, r. & Bell, D. (2013). Medizinische Physiologie: Grundsätze für die klinische Medizin (4. Aufl.). Lippinott Williams & Wilkins.
- Spudich, J. ZU. (2001). Das Myosin schwingende Cross-Bridge-Modell. Nature Reviews Molekulare Zellbiologie, 2(5), 387-392.
- Thibodeau, p. (2013). Anatomie und Phisiologie (8th). Mosby, Inc.
- Tortora, g. & Derrickson, b. (2012). Prinzipien der Anatomie und Physiologie (13. Ausgabe.). John Wiley & Sons Inc.

