Zweites Gesetz der Thermodynamikformeln, Gleichungen, Beispiele

- 811
- 7
- Nick Laurén
Der Zweites Gesetz der Thermodynamik hat verschiedene Formen des Ausdrucks. Einer von ihnen gibt an, dass keine thermische Maschine in der Lage ist, alle Energie, die sie absorbiert, vollständig in nutzbare Arbeit umzuwandeln (Kelvin-Planck-Formulierung). Eine andere Möglichkeit, zu sagen, dass es in einem solchen Sinne zu sagen ist, dass reale Prozesse auftreten, dass die Energiequalität niedriger ist, weil die Entropie Es neigt dazu zu steigen.
Dieses Gesetz, auch bekannt als zweites Prinzip der Thermodynamik, wurde von Beginn des 19. Jahrhunderts bis heute auf unterschiedliche Weise zum Ausdruck gebracht, obwohl seine Ursprünge aus der Schaffung der ersten Dampfmaschinen in England stammen. Zu Beginn des 18. Jahrhunderts.
 Abbildung 1. Beim Bau der Baublöcke auf dem Boden wäre es sehr überraschend, den Fall zu fallen. Quelle: Pixabay.
Abbildung 1. Beim Bau der Baublöcke auf dem Boden wäre es sehr überraschend, den Fall zu fallen. Quelle: Pixabay. Aber obwohl es in vielerlei Hinsicht zum Ausdruck gebracht wird, wird in all der Idee, dass Materie tendenziell eine Störung neigt und dass es immer kein 100 %er Prozess gibt, da immer Verluste existieren werden.
Alle thermodynamischen Systeme haften an dieses Prinzip, beginnend mit dem Universum selbst bis zur Tasse Morgenkaffee, die leise auf dem Tisch warten und mit der Umwelt Wärme austauschen.
Der Kaffee kühlt sich im Laufe der Zeit ab, bis er im thermischen Gleichgewicht mit der Umwelt ist. Es wäre also sehr überraschend, wenn eines Tages im Gegenteil der Fall wäre und die Atmosphäre abkühlen würde, während sich der Kaffee für sich selbst erhitzen würde. Es ist unwahrscheinlich, dass es passieren wird, einige sagen das unmöglich, aber es reicht aus, sich vorzustellen, dass es eine Vorstellung von dem Sinn hat, in dem Dinge spontan passieren.
In einem anderen Beispiel wird es schließlich aufhören, ein Buch auf die Oberfläche eines Tisches zu schieben, da seine kinetische Energie in Form von Wärme aufgrund von Reibung verloren geht.
Das erste und zweite Gesetz der Thermodynamik wurde um 1850 dank Wissenschaftlern wie Lord Kelvin -Schöpfer des Begriffs "Thermodynamik" -, William Rankine -Autor des ersten formalen Textes der Thermodynamik -und Rudolph Clausius, gegründet -und Rudolph Clausius.
[TOC]
Formeln und Gleichungen
Entropie -weniger als der Anfang -hilft uns, den Sinn, in dem Dinge passieren. Kehren wir zum Beispiel der Körper im thermischen Kontakt zurück.
Wenn zwei Objekte bei unterschiedlichen Temperaturen in Kontakt gebracht werden und schließlich nach einer Weile das Wärmeausgleich erreichen, werden sie durch die Tatsache getrieben, dass die Entropie ihr Maximum erreicht, wenn die Temperatur von beiden gleich ist.
Bezeichnung von Entropie als S, Die Änderung der Entropie ΔS eines Systems wird gegeben durch:

Die Änderung der Entropie ΔS Es zeigt den Grad der Störung in einem System an, aber es gibt eine Einschränkung der Verwendung dieser Gleichung: Es ist nur für reversible Prozesse anwendbar passiert-.
In irreversiblen Prozessen manifestiert sich das zweite Gesetz der Thermodynamik wie folgt:
Kann Ihnen dienen: Reynolds Nummer: Wofür ist es, wie es berechnet wird, Übungen
Reversible und irreversible Prozesse
Die Kaffeetasse kühlt immer ab und ist ein gutes Beispiel für einen irreversiblen Prozess, da sie immer in eine Richtung auftritt. Wenn der Kaffee und Rühren eine Sahne hinzugefügt wird, wird eine sehr angenehme Kombination erhalten, aber egal wie rühren, der Kaffee und die Creme nicht wieder sein, da das Rühren irreversibel ist.
 Figur 2. Cup Breakage ist ein irreversibler Prozess. Quelle: Pixabay.
Figur 2. Cup Breakage ist ein irreversibler Prozess. Quelle: Pixabay. Obwohl die meisten täglichen Prozesse irreversibel sind, sind einige einige fast Reversibel. Reversibilität ist eine Idealisierung. Um ausgeführt zu werden, muss sich das System sehr langsam ändern, so dass es an jedem Punkt immer im Gleichgewicht ist. Auf diese Weise ist es möglich, es in einen früheren Zustand zurückzugeben, ohne eine Markierung zu hinterlassen.
Die Prozesse, die diesem Ideal ziemlich nahe kommen.
Die Reibungskraft ist für einen Großteil der Irreversibilität verantwortlich, da die von ihr erzeugte Wärme nicht die Art von Energie ist. In dem Buch, das über den Tisch gleitet, ist Wärme nach Reibung Energie, die nicht wiederhergestellt wird.
Obwohl das Buch in seine ursprüngliche Position zurückkehrt, war der Tisch heiß als Fußabdruck, um zu kommen und zu gehen.
Beobachten Sie nun eine Glühbirne: Der größte Teil der Arbeit, die von dem Strom geleistet wird, das das Filament überquert. Nur ein kleiner Prozentsatz wird verwendet, um Licht auszugeben. In beiden Prozessen (Buch und Glühbirne) hat die Entropie des Systems zugenommen.
Anwendungen
Ein idealer Motor ist derjenige, der durch reversible Prozesse gebaut wird und keine Reibung verursacht, die Energieabfälle verursacht, sich drehen fast Alle thermischen Energie in nutzbarer Arbeit.
Wir betonen das Wort fast, weil nicht einmal der ideale Motor, der Carnots, zu 100% Effizienz hat. Das zweite Gesetz der Thermodynamik ist nicht auf diese Weise.
Carnot -Motor
Carnots Motor ist der effizienteste Motor, der entwickelt werden kann. Es arbeitet zwischen zwei Temperaturablagerungen in zwei isothermen Prozessen - bei konstanter Temperatur - und zwei adiabatischen Prozessen - ohne thermische Energieübertragung-.
Die Graphen, die als PV -Druckdiagramme bezeichnet werden - Volumen - Klären Sie die Situation:
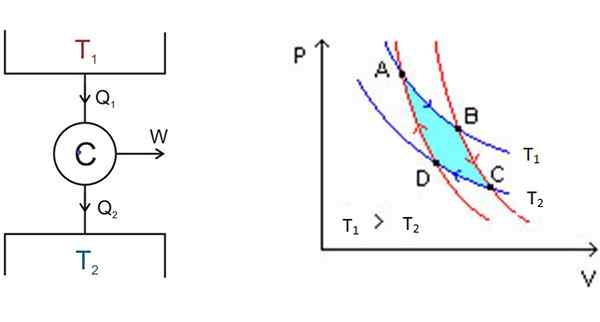 Figur 3. Links das Carnot-Motorschema und rechts das P-V-Diagramm. Quelle: Wikimedia Commons.
Figur 3. Links das Carnot-Motorschema und rechts das P-V-Diagramm. Quelle: Wikimedia Commons. Links in Abbildung 3 befindet sich das Carnot C Motorschema, das Hitze q nimmt1 der Ablagerung bei Temperatur t1, Umwandeln Sie diese Wärme in die Arbeit W und geben Sie in Abfall ein2 zur kältesten Ablagerung, die bei Temperatur t ist2.
Ausgehend von a dehnt sich das System aus, bis es B erreicht, und absorbiert Wärme auf feste Temperatur t1. In B beginnt das System eine adiabatische Expansion, bei der keine Wärme gewonnen oder verloren geht, um zu C zu gelangen.
In c beginnt ein weiterer isothermischer Prozess: Wärme für die andere kältere thermische Ablagerung zu verleihen, die bei T ist2. Damit ist das System komprimiert und Punkt D ist erreicht. Dort beginnt ein zweiter adiabatischer Prozess, um zum Startpunkt zurückzukehren zu. Auf diese Weise wird ein Zyklus abgeschlossen.
Es kann Ihnen dienen: Wärmeübertragung durch Fahren (mit Beispielen)Die Effizienz von Carnot hängt von den Temperaturen in Kelvin auf den beiden Wärmeleitungen ab:
Maximale Effizienz = (qEingang - QAusfahrt) /QEingang = 1 - (t2/T1)
Carnots Theorem stellt fest, dass dies die effizienteste thermische Maschine ist, aber beeilen Sie sich nicht, es zu kaufen. Erinnern Sie sich daran, was wir über die Reversibilität von Prozessen gesagt haben? Sie müssen sehr, sehr langsam passieren, so dass die Ausgangsleistung dieser Maschine praktisch null ist.
Menschlicher Stoffwechsel
Menschen brauchen Energie, um alle Systeme am Laufen zu halten. Deshalb verhalten sie sich als Wärmemaschinen, die Energie erhalten und sie in mechanische Energie umwandeln, um sich beispielsweise zu bewegen.
Effizienz Und des menschlichen Körper.
Wie die durchschnittliche Leistung pM Es wird in einem Zeitintervall gearbeitet Δt, Es kann ausgedrückt werden als:
PM = W/Δt
Ja ΔU/ΔT Es ist die Geschwindigkeit, zu der Energie zugesetzt wird, die Körpereffizienz bleibt:

Durch zahlreiche Tests mit Freiwilligen wurden Effizienz von bis zu 17%erhalten, die mehrere Stunden lang etwa 100 Watt Strom liefern.
Dies hängt natürlich weitgehend von der Aufgabe ab, die erledigt ist. Das Treten eines Fahrrads hat etwas größere Effizienz von etwa 19 %, während sich wiederholende Aufgaben, die Klingen, Peaks und Hacken umfassen.
Beispiele
Das zweite Gesetz der Thermodynamik ist in allen Prozessen impliziert, die im Universum auftreten. Entropie wächst immer, obwohl es in einigen Systemen zu sinken scheint. Damit dies anderswo zugenommen hat, so ist es im Gesamtbetrag positiv.
- Beim Lernen gibt es Entropie. Es gibt Menschen, die die Dinge gut und schnell lernen, zusätzlich dazu, sich leicht an sie zu erinnern. Es wird gesagt, dass es sich.
- Ein Unternehmen mit unorganisierten Arbeitnehmern hat mehr Entropie als eines, bei dem Arbeiter ordentlich Aufgaben erledigen. Es ist klar, dass letzteres effizienter sein wird als der erste.
- Die Reibungskräfte erzeugen bei der Funktion von Maschinen weniger Effizienz.
- Das Starten eines Würfels hat eine größere Entropie, als eine Münze in die Luft zu werfen. Schließlich hat das Starten einer Währung nur zwei mögliche Ergebnisse, während das Starten der Würfel 6 ist. Je mehr Ereignisse wahrscheinlich sind, desto mehr Entropie existiert.
Kann Ihnen dienen: Was sind die Elemente der Bewegung??Gelöste Übungen
Übung 1
Ein Zylinder mit einem Kolben wird mit einer Mischung aus Flüssigkeit und Wasserdampf bei 300 K gefüllt und 750 kJ Wärme wird auf einen konstanten Druckprozess übertragen. Infolgedessen wird die Flüssigkeit im Zylinder verdampft. Berechnen Sie die Entropieänderung im Prozess.
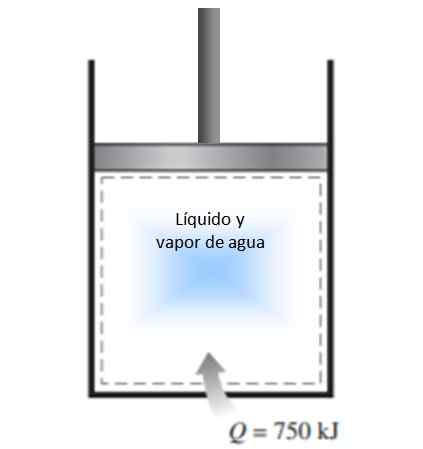 Figur 4. Abbildung für das Beispiel gelöst 1. Quelle: f. Zapata.
Figur 4. Abbildung für das Beispiel gelöst 1. Quelle: f. Zapata. Lösung
Der in der Aussage beschriebene Prozess wird in einem geschlossenen System mit konstantem Druck durchgeführt, bei dem kein Massenaustausch auftritt.
Da es sich um die Verdampfung handelt, in der sich die Temperatur nicht ändert (während der Phasenänderungen ist die Temperatur konstant), kann die oben angegebene Definition der Entropieänderung angewendet werden und die Temperatur kann aus dem Integral herauslassen:

ΔS = 750.000 J / 300 K = 2500 J / K.
Da das System zum System kommt, ist die Änderung der Entropie positiv.
Übung 2
Ein Gas erleidet eine Druckerhöhung von 2.00 bis 6.00 Atmosphären (ATM), die ein konstantes Volumen von 1 aufrechterhalten.00 m3, und dann mit konstantem Druck ausdehnen, bis es ein Volumen von 3 erreicht.00 m3. Kehren Sie schließlich in seinen Anfangszustand zurück. Berechnen Sie, wie viel Arbeit in 1 Zyklus durchgeführt wird.
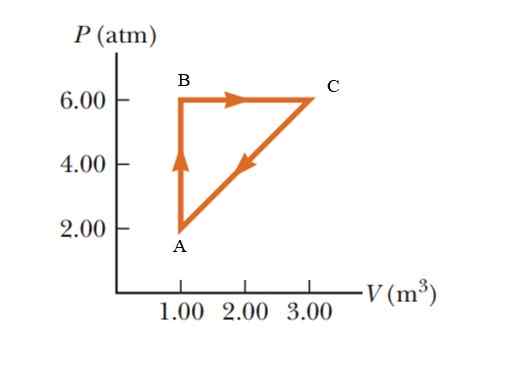 Abbildung 5. Thermodynamischer Prozess in einem Gas für 2. Quelle: Serway -vulle. Grundlagen der Physik.
Abbildung 5. Thermodynamischer Prozess in einem Gas für 2. Quelle: Serway -vulle. Grundlagen der Physik. Lösung
Es ist ein zyklischer Prozess, bei dem die interne Energievariation gemäß dem ersten Gesetz der Thermodynamik ungültig ist, daher q = w. In einem P -V -Diagramm (Druck - Volumen) entspricht die während eines zyklische Prozesses geleistete Arbeit dem Bereich, der durch die Kurve gesperrt ist. Um die Ergebnisse im internationalen System zu geben, müssen die Einheiten im Druck durch den folgenden Konversionsfaktor geändert werden:
1 atm = 101.325 kPa = 101.325 pa.
Der von der Grafik eingeschlossene Bereich entspricht dem eines Dreiecks, dessen Basis (3 - 1 m)3) = 2 m3 und deren Größe (6 - 2 atm) = 4 atm = 405 ist.300 pa
WABCA = ½ (2 m)3 x 405300 pa) = 405300 J = 405.3 KJ.
Übung 3
Es wird gesagt, dass eine der effizientesten Maschinen, die gebaut wurden.
Berechnen Sie: a) Maximale theoretische Effizienz, b) die von der Maschine gelieferte mechanische Leistung, falls absorbiert 1.40 x 105 J Energie jede Sekunde aus dem heißen Tank. Es ist bekannt, dass die echte Effizienz 42 beträgt.0%.
Lösung
a) Die maximale Effizienz wird mit der oben angegebenen Gleichung berechnet:
Maximale Effizienz = (qEingang - Q Ausfahrt) /QEingang = 1 - (t2/T1)
Um den Celsius an Kelvin zu übergeben, reicht es aus, 273 hinzuzufügen.15 bei der Celsius -Temperatur:
Multiplizieren mit 100% Sie haben eine maximale prozentuale Effizienz, die 67 beträgt.2%
c) Wenn die tatsächliche Effizienz 42%beträgt, gibt es eine maximale Effizienz von 0.42.
Die gelieferte mechanische Leistung ist: p = 0.42 x 1.40 x 10 5 J/S = 58800 W.
Verweise
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 1. Mc Graw Hill.
- Cengel, und. 2012. Thermodynamik. 7ma Auflage. McGraw Hill.
- Figueroa, d. (2005). Serie: Physik für Wissenschaft und Ingenieurwesen. Band 4. Flüssigkeiten und Thermodynamik. Herausgegeben von Douglas Figueroa (USB).
- Ritter, r. 2017. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz.
- López, c. Das erste Gesetz der Thermodynamik. Erholt von: Culturacientifica.com.
- Serway, r. 2011. Grundlagen der Physik. 9n / A Cengage Lernen.
- Sevilla University. Wärmemaschinen. Erholt von: Laplace.uns.Ist
- « Prinzipien, Perioden und Muster der Anwaltstheorie
- Änderungen der Zustandstypen und ihrer Merkmale (mit Beispielen) »


=0.672)